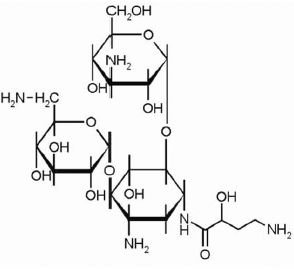
Что лучше амикацин или цефотаксим при пневмонии
Ошибки в антибактериальной терапии инфекций дыхательных путей в амбулаторной практике
Опубликовано в журнале:
Лечащий врач, 2003, №8 Л. И. Дворецкий, доктор медицинских наук, профессор
С. В. Яковлев, доктор медицинских наук, профессор
ММА им. И. М. Сеченова, Москва
При выборе способа антибактериальной терапии в амбулаторной практике необходимо учитывать и решать как тактические, так и стратегические задачи. К тактическим задачам антибиотикотерапии относится рациональный выбор антибактериального препарата, обладающего наибольшим терапевтическим и наименьшим токсическим воздействием.
Стратегическая задача антибиотикотерапии в амбулаторной практике может быть сформулирована как уменьшение селекции и распространения резистентных штаммов микроорганизмов в популяции.
В соответствии с этими положениями следует выделять тактические и стратегические ошибки при проведении антибактериальной терапии инфекций дыхательных путей в амбулаторной практике (см. таблицу 1).
Таблица 1. Ошибки антибактериальной терапии в амбулаторной практике.
Тактические ошибки антибактериальной терапии
1. Необоснованное назначение антибактериальных средств
Особую категорию ошибок представляет неоправданное применение антибактериальных препаратов (АП) в тех ситуациях, когда их назначение не показано.
Показанием для назначения антибактериального препарата является диагностированная или предполагаемая бактериальная инфекция.
При всех трудностях принятия решения в подобных ситуациях необходимо отдавать себе отчет в том, что антибактериальные препараты не оказывают влияния на течение вирусной инфекции и, следовательно, их назначение при ОРВИ не оправдано (см. таблицу 2). В то же время предполагаемая возможность предотвращения бактериальных осложнений вирусных инфекций с помощью назначения антибактериальных препаратов не находит себе подтверждения в клинической практике. Кроме того, очевидно, что широкое неоправданное применение антибактериальных препаратов при ОРВИ чревато формированием лекарственной устойчивости и повышением риска возникновения нежелательных реакций у пациента.
Таблица 2. Инфекционные заболевания дыхательных путей преимущественно вирусной этиологии
и не требующие антибактериальной терапии.
Часто врач назначает нистатин или другой антимикотик в случае обнаружения в полости рта или в моче грибов рода Candida. При этом он ориентируется лишь на данные микробиологического исследования и не учитывает наличие или отсутствие симптомов кандидоза, а также факторов риска развития грибковой инфекции (тяжелый иммунодефицит и др.).
Выделение грибов рода Candida из полости рта или мочевых путей пациентов в большинстве случаев служит свидетельством бессимптомной колонизации, не требующей коррегирующей противогрибковой терапии.
II. Ошибки в выборе антибактериального препарата
Пожалуй, наибольшее число ошибок, возникающих в амбулаторной практике, связано с выбором антибактериального средства. Выбор антибиотика должен производиться с учетом следующих основных критериев:
Основы антибактериальной терапии внебольничной пневмонии у больных пожилого возраста
Какие возбудители пневмонии наиболее типичны у пожилых людей? Каковы принципы выбора антибиотиков у пожилых людей? Важным фактором риска развития острой пневмонии является пожилой и старческий возраст, что приобретает особое значение в связи с увеличе
Какие возбудители пневмонии наиболее типичны у пожилых людей?
Каковы принципы выбора антибиотиков у пожилых людей?
Важным фактором риска развития острой пневмонии является пожилой и старческий возраст, что приобретает особое значение в связи с увеличением продолжительности жизни в развитых странах. Пневмонии у лиц пожилого и старческого возраста представляют серьезную проблему из-за значительной частоты, трудностей диагностики и лечения, высокой летальности. В возрастной группе старше 60 лет заболеваемость пневмонией составляет от 20 до 40 случаев на 1000 населения. В Москве распространенность внебольничных пневмоний среди лиц пожилого и старческого возраста составляет 17,4 на 1000. В последние годы отмечается тенденция к увеличению смертности от пневмонии; в середине 90-х годов она достигла отметки 18 на 100 тыс. населения.
Пневмония у лиц старше 60 лет обычно развивается в условиях анатомически измененной легочной паренхимы, нарушений вентиляции и перфузии. Возрастные изменения многих органов и тканей определяют снижение способности организма человека препятствовать проникновению патогенных микроорганизмов и противостоять развитию инфекционного процесса.
У пожилых людей инфекционное заболевание часто характеризуется скудной клинической симптоматикой: отсутствием острого начала, слабовыраженной лихорадочной реакцией, умеренными изменениями лейкоцитарной формулы. Иногда инфекция у таких пациентов протекает атипично и клинически может проявляться симптомами со стороны ЦНС (заторможенность, сонливость, слабость, нарушение сознания, изменения психики, головная боль, головокружения и т. д.), внезапным появлением или прогрессированием дыхательной, сердечной или почечной недостаточности.
Одна из особенностей больных пожилого и старческого возраста — это наличие двух или более сопутствующих заболеваний, которые, влияя как на патогенез пневмонии, так и на фармакокинетику лекарств, отягощают течение инфекционного процесса и увеличивают вероятность осложнений. У 80-90% пожилых больных наиболее часто встречаются сердечная недостаточность, хронические обструктивные заболевания легких, неврологические сосудистые заболевания, сахарный диабет, хроническая почечная недостаточность, заболевания печени, опухоли.
Выбор антибактериальной терапии пневмонии, как правило, должен быть основан на этиологическом принципе, который может включать внебольничный и внутрибольничный характер пневмонии, наличие и специфику фоновой патологии, эпидемиологическую обстановку, особенности клинико-рентгенологической ситуации. Наиболее частым возбудителем внебольничной пневмонии, в том числе и у пожилых, остается S. pneumoniae, на долю которого приходится 30% и более случаев заболевания. Однако у пожилых больных возрастает роль грамотрицательных микроорганизмов, таких как H. influenzae (8–25%), E. coli, Рoteus spp., Kl. pneumoniae. Развитие нетяжелой пневмонии у лиц старше 60 лет чаще всего связывается с инфекцией S. pneumoniae, H. influenzae и аэробными грамотрицательными микроорганизмами. В этиологической структуре внебольничной пневмонии тяжелого течения доминируют S. aureus, P. aeruginosa, L. pneumophila и K. pneumoniae.
В практической медицине не всегда удается выявить возбудитель пневмонии из-за отсутствия у 30-35% больных (а у пожилых — более 50%) продуктивного кашля в ранние сроки заболевания и значительной продолжительности традиционных микробиологических исследований. Таким образом, основным подходом в терапии внебольничной пневмонии у пожилых является эмпирический выбор антибактериальных средств.
Лечение у лиц пожилого и старческого возраста сопряжено со значительными сложностями. Основным принципом лекарственной терапии в гериатрии должно быть применение только необходимых препаратов, обладающих наибольшей эффективностью при минимальном побочном действии. В то же время, кроме лекарственной терапии пневмонии и ее осложнений, лица старше 60 лет нередко нуждаются в приеме медикаментов для лечения сопутствующих заболеваний. Несмотря на то что политерапия может привести к увеличению частоты побочных действий, отмена антиаритмических, коронароактивных и некоторых других препаратов часто невозможна. Полипрогмазию следует воспринимать как особенность, свойственную пожилому возрасту.
С возрастом изменяется фармакокинетика лекарственных средств, что может привести к изменению фармакодинамических эффектов. Возрастное уменьшение проникновения лекарств в ткани в результате снижения объема распределения и снижения уровня тканевого кровотока может являться одной из причин недостаточной клинической и бактериологической эффективности антибиотиков у больных пожилого возраста. С возрастом уменьшается уровень метаболизма лекарств в печени в результате уменьшения массы печени, печеночного кровотока и активности микросомальных ферментов, что приводит к уменьшению клиренса и повышению сывороточных концентраций тех антибактериальных средств, которые в основном метаболизируются в печени. В результате атрофии коркового слоя почек с возрастом снижается уровень клубочковой фильтрации. У больных пожилого возраста экскреция многих лекарственных средств замедляется, что приводит к увеличению их концентрации в крови. Дозы антибактериальных препаратов, имеющих преимущественно почечный путь элиминации, у пожилых больных желательно корректировать в зависимости от индивидуальной величины клубочковой фильтрации. Это особенно важно для потенциально токсичных лекарств, таких как аминогликозиды, ванкомицин, карбенициллин, тикарциллин, тетрациклины.
Антибактериальная терапия должна быть ранней и адекватной по дозе, способу применения и длительности использования, а также корригируемой в процессе лечения в зависимости от клинического эффекта. Эффективность лечения в первую очередь зависит от правильного выбора антибактериального препарата и соответствия его этиологии заболевания. Кроме того, необходимо знать о наличии и возможности антибиотикорезистентности в данной ситуации, учесть тяжесть пневмонии, функциональное состояние печени или почек и риск развития побочных эффектов.
Тяжесть пневмонии также является одним из клинических ориентиров в выборе первоначального антибактериального препарата и путей его введения. При назначении антибактериальной терапии необходимо учитывать возможные побочные эффекты препаратов и избегать назначения лекарственных средств, которые могут вызвать нежелательные эффекты и ухудшить течение основного и сопутствующих заболеваний. Не рекомендуется применять антибиотики с бактериостатическим действием (тетрациклины, хлорамфеникол, сульфаниламиды), так как вследствие снижения защитных сил пожилого организма при лечении этими препаратами высока вероятность неполного бактериологического эффекта, что увеличивает риск развития рецидива инфекции и хронизации инфекционного процесса. Кроме того, при применении бактериостатиков повышен риск селекции устойчивых штаммов микроорганизмов и развития суперинфекции.
Имеющийся опыт свидетельствует о том, что в России тяжелые внебольничные пневмонии у пожилых часто лечат комбинациями из β-лактамов и аминогликозидов, что нельзя считать достаточно обоснованным. Аминогликозидные антибиотики не активны в отношении пневмококков и атипичных патогенов, малоактивны в отношении стафилококков. В качестве аргументов в пользу такой комбинации обычно ссылаются на возможность расширения спектра действия комбинации, проявление синергизма и преодоление возможной резистентности. Однако представление о высокой степени синергизма между бета-лактамами и аминогликозидами несколько преувеличено, так как эта комбинация не приводит к усилению клинического эффекта. Устойчивость грамотрицательных микроорганизмов к цефалоспоринам III поколения в настоящее время практически всегда ассоциируется с резистентностью к гентамицину и тобрамицину (в частности, в Москве). Кроме того, использование аминогликозидов должно сопровождаться контролем функции почек и слуха.
В нашей стране в течение многих лет при эмпирическом лечении пневмоний использовали внутримышечное введение пенициллина, однако, изменение спектра возбудителей с довольно высоким удельным весом гемофильной палочки, микоплазмы и других бактерий, нечувствительных к пенициллину, диктует изменение тактики антибактериальной терапии. Появление пенициллинорезистентных штаммов пневмококка, а также необходимость введения пенициллина каждые 3-4 часа требует замены препарата первой линии для лечения амбулаторных пневмоний.
Для лиц старше 60 лет чаще применяют антибиотики широкого спектра действия. Это оправданно из-за полиэтиологичности пневмоний у этого контингента, широкой распространенности ассоциаций грамположительных и грамотрицательных микроорганизмов. Пероральное применение препаратов имеет ряд несомненных преимуществ перед парентеральным — в частности, оно безопаснее, проще и дешевле. Предпочтение следует отдать средствам с различными формами введения с использованием режима «ступенчатой» терапии.
В абсолютном большинстве случаев необходимо предпочесть монотерапию, преимущества которой состоят в уменьшении риска неадекватного взаимодействия антибактериальных средств, нежелательных взаимодействий с другими лекарственными средствами, риска развития токсических явлений, в облегчении работы медперсонала, снижении стоимости лечения.
В целях оптимизации антибактериальной терапии на основании многоцентровых исследований были предложены многочисленные алгоритмы лечения внебольничной пневмонии у пожилых больных. Так, С. В. Яковлев (1999) предлагает дифференцированный подход к терапии больных пожилого возраста, разделяя их на группы. Для амбулаторных пациентов без сопутствующей патологии препаратами выбора являются: амоксициллин/клавулановая кислота перорально и цефуроксим аксетил, как альтернативные средства — амоксициллин, ампициллин, доксициклин и грепафлоксацин. Для амбулаторных больных с сопутствующей патологией — цефтриаксон и грепафлоксацин. Амоксициллин/клавулановая кислота и фторхинолоны (ципрофлоксацин и офлоксацин) у данной категории больных являются альтернативными. У госпитализированных больных при нетяжелом и неосложненном течении пневмонии препаратами первого ряда являются цефуроксим или амоксициллин/клавуланат внутривенно. Альтернативными — грепафлоксацин, цефалоспорины III поколения (цефотаксим* или цефтриаксон) внутривенно, доксициклин. У госпитализированных больных при тяжелом течении — цефалоспорины III поколения внутривенно + макролид внутривенно. В качестве альтернативы в данной группе могут применяться фторхинолоны внутривенно.
В октябре 1998 года на VIII Национальном конгрессе по болезням органов дыхания (Москва) были представлены рекомендации по антибиотикотерапии у взрослых, разработанные Комиссией по антибактериальной политике при Минздраве РФ и РАМН, в соответствии с которыми для больных пневмонией в возрасте 60 лет и старше и с сопутствующими заболеваниями в качестве средств выбора рекомендуются «защищенные» аминопенициллины (ампициллин/сульбактам**, амоксициллин/клавуланат) или целафоспорины II поколения (цефуроксим-аксетин). Учитывая вероятность у данной группы пациентов хламидийной или легионеллезной инфекции, оправданным представляется комбинированное лечение с использованием макролидных антибиотиков.
При тяжелой внебольничной пневмонии, в том числе и у пожилых больных, средствами выбора являются парентерально вводимые цефалоспорины III поколения (цефотаксим или цефтриаксон) в комбинации с макролидами для парентерального введения (эритромицин, спирамицин). Приведенная комбинация перекрывает практически весь спектр потенциальных этиологических агентов тяжелой внебольничной пневмонии — как «типичных», так и «атипичных».
В Федеральном руководстве для врачей по использованию лекарственных средств (формулярная система) 2000 года в разделе «Противомикробные средства» для лечения внебольничной пневмонии у пациентов старше 60 лет и с сопутствующими заболеваниями рекомендованы амоксициллин/клавуланат или цефалоспорины II-III поколения + макролид. При клинически тяжелых пневмониях: бензилпенициллин + макролид парентерально, цефотаксим или цефтриаксон + макролид парентерально, фторхинолоны. При абсцедирующей пневмонии — ампициллин/сульбактам или амоксициллин/клавуланат, линкозамид + целафоспорины II-III поколения (или фторхинолоны), имипенем или меропенем.
В данных рекомендациях в основном перечислены группы препаратов (например, цефалоспорины III поколения, макролиды и т. д.) без конкретизации особенностей отдельных препаратов внутри группы и без учета разнообразных клинических, фармакокинетических и фармакоэкономических показателей. Без ущерба клинической эффективности с учетом характерных особенностей в каждой группе можно выделить наиболее оптимальные препараты для лечения внебольничной пневмонии. Так, из цефалоспоринов III поколения — цефтриаксон (длительный период полувыведения), из макролидов — спирамицин (парентеральная и пероральная формы введения), из линкозамидов — клиндамицин (активнее и безопаснее линкомицина и лучше всасывается при приеме внутрь). Из фторхинолонов предпочтительнее новые фторхинолоны (моксифлоксацин, левофлоксацин), так как ципрофлоксацин, пефлоксацин и офлоксацин характеризуются сниженной активностью против пневмококков. Карбапенемы целесообразно использовать как препараты выбора в случаях, угрожающих жизни больного, а также как препараты резерва при неэффективности предыдущей антибактериальной терапии.
Адекватный выбор первоначального антибактериального препарата имеет не только клиническое значение. Здесь нельзя также не учитывать экономические аспекты, особенно у пожилых больных, поскольку ошибка в выборе сама по себе влечет за собой экономические убытки.
В настоящее время все более актуальным становится вопрос стоимости эффективной терапии. Примерно 60% пациентов старше 65 лет относятся к льготной категории населения, имеющей право на бесплатное (или с 50%-ной скидкой) приобретение лекарственных препаратов. Поэтому вопрос правильного выбора с точки зрения фармакоэкономики и затратно-эффективного отбора лекарственного препарата для лечения пожилого человека приобретает не только медицинский, но и социальный характер.
Таким образом, основой лечения пневмоний является адекватная антимикробная терапия: учет соответствия назначаемого антибактериального средства выделенному или предполагаемому возбудителю; оптимальная дозировка; оптимизация путей введения препарата; учет осложнений заболевания и сопутствующей патологии; профилактика возможных побочных эффектов от применения препаратов; обоснованная длительность лечения; учет стоимости препарата.
Литература
1. Алексеев В. Г., Яковлев В. Н. Очерки клинической пульмонологии. М., 1998. С. 176.
2. Антибактериальная терапия пневмоний у взрослых. Учебно-метод. пособие для врачей. М.: РМ-Вести. 1998. С. 28.
3. Дворецкий Л. И. Пневмонии у больных пожилого и старческого возраста. М. РМЖ. 1998, т. 6. № 21. С. 1364-1372.
4. Дворецкий Л. И., Лазебник Л. Б., Яковлев С. В. Диагностика и лечение бактериальных инфекций у пожилых // М.: Универсум Паблишинг, 1997. С. 54.
5. Ноников В. Е. Пневмонии в пожилом и старческом возрасте // М. Ж. Клинич. геронтол. / 1995, № 1. С. 9-13.
6. Федеральное руководство для врачей по использованию лекарственных средств (формулярная система). Раздел 5: «Противомикробные средства»/ М. 2000.
7. Яковлев С. В. Внебольничная пневмония у пожилых: особенности этиологии, клинического течения и антибактериальной терапии. М.: РМЖ. т. 7, № 16. С. 763-768.
Обратите внимание!
* В России производится под торговым названием Цефосин®
** В России производится под торговым названием Сультасин®
Антибиотики нового поколения: за и против
Антибиотики – это вещества биологического или полусинтетического происхождения. Применяются в лечебной практике для борьбы с болезнетворными микробами, вирусами. До появления этих медпрепаратов статус неизлечимых болезней был у брюшного тифа, дизентерии, пневмонии, туберкулеза. Сегодня лечение заболеваний инфекционного характера возможно с применением 1-6 поколения антибиотиков.
На этот момент фармакологическая индустрия выпускает более 2000 разновидностей лекарственных средств подобного типа. Медики описали действие около 600 позиций, а во врачебной практике используются порядка 120-160 препаратов.
Важно! При любом заболевании принимать антибиотики рекомендуется после консультации с врачом. В противном случае может развиться антибиотикорезистентность (снижение чувствительности патогенных микроорганизмов к антибактериальным средствам).
Классификация антибиотиков
Все антибактериальные средства можно разделить на 5 категорий по характеристикам и спектру применения. Рассмотрим эту классификацию подробнее:
Спектр действия
Различают антибактериальные средства:
По составу
Антибактериальные препараты делят на 6 групп:
Поколения препаратов. У передовых антимикробных препаратов насчитывается уже шесть генераций. Например, пенициллин был первым средством природного происхождения, тогда как третья или шестая генерация – это уже улучшенная версия, которая включает в состав сильнейшие ингибиторы. Зависимость прямая: чем новее генерация, тем эффективнее воздействие препаратов на патогенную микрофлору.
По способу приема. Пероральные – принимают через рот. Это различные сиропы, таблетки, растворимые капсулы, суспензии. Парентеральные – вводятся внутривенно или внутримышечно. Они быстрее дают эффект, чем пероральные лекарства. Ректальные препараты вводятся в прямую кишку.
Важно! Принимать антибиотики допускается только после консультации с врачом, иначе разовьется антибиотикорезистентность.
Антибактериальные средства нового поколения
Отличие последних генераций антибиотиков от их ранних версий в более совершенной формуле действующего вещества. Активные компоненты точечно устраняют только патологические реакции в клетке. Например, кишечные антибиотики нового поколения не нарушают микрофлору ЖКТ. При этом они борются с целой «армией» возбудителей инфекций.
Новейшие антибактериальные препараты делятся на пять групп:
Рассмотрим несколько известных противомикробных средств импортного и российского производства.
Амоксициллин – импортный противомикробный препарат из группы пенициллинов. Используется во врачебной практике для лечения бактериальной инфекции. Эффективен при кишечных инфекциях, гайморите, ангине, болезни Лайма, дизентерии, сепсисе.
Авелокс – медпрепарат последней генерации из группы фторхинолонов. Отличается сильнейшим воздействием на бактериальные и атипичные возбудители. Не вредит почкам и ЖКТ. Используется при острых, хронических заболеваниях.
Цефалоспорины – антибиотики третьего поколения. К этой группе относят Цефтибутен, Цефтриаксон и другие. Используются для лечения пиелонефрита, пневмонии. В целом это безопасные средства с малым количеством побочных действий. Однако их нужно принимать только после консультации с врачом. Медпрепаратов много, а какой именно выбрать – порекомендует специалист.
Дорипрекс – импортный противомикробный препарат синтетического происхождения. Показал хорошие результаты при лечении пневмонии, запущенных интраабдоминальных инфекций, пиелонефритах.
Инваз – антибактериальное средство из группы карбапенемов. Выпускается в ампулах для парентерального способа применения. Показывает быстрый эффект при лечении бактериальных расстройств кожи, мягких тканей, инфекциях мочевыводящих путей, пневмонии, септицемиях.
Аугметин – полусинтетический пенициллин третьей генерации с добавлением усиливающих ингибиторов. Педиатрами признается лучшим комплексным медпрепаратом для лечения детских гайморита, бронхита, тонзиллита и других инфекций дыхательных путей.
Цефамандол – антибактериальное средство российского производства. Относится к группе цефалоспоринов третьего поколения. Используется для лечения кишечных инфекций, возбудителей инфекций половых органов. Как противомикробное средство обширного диапазона воздействия применяется при простудных заболеваниях.
Лучшие антибактериальные препараты широкого диапазона действия
Противомикробные средства новой генерации обычно синтезируют из природного сырья и стабилизируют в лабораториях. Это помогает усилить эффект лекарства на патогенную микрофлору.
Какие препараты самые сильные? Врачи относят к таким антибактериальные средства широкого спектра воздействия. Приведем ниже краткий список препаратов по названиям:
Резюме
Мы рассмотрели российские и импортные антибиотики широкого спектра действия, кратко описали классификацию препаратов. Ответим на вопрос: какие антибактериальные средства выбрать?
Важно понимать, противомикробные лекарства для обширного применения обладают токсичностью, поэтому негативно влияют на микрофлору. Кроме того, бактерии мутируют, а значит препараты теряют свою эффективность. Поэтому антибактериальные средства с новейшей структурой будут в приоритете, чем их ранние аналоги.
Самолечение антибиотиками опасно для здоровья. При инфекционном заболевании первым делом нужно обратиться к врачу. Специалист установит причину болезни и назначит эффективные антибактериальные средства. Самолечение «наугад» приводит к развитию антибиотикорезистентности.
Аминогликозиды с позиций современной практики лечения инфекций дыхательных путей
Появление аминогликозидных антибиотиков ведет свое начало с открытия исследовательской группой Зельмана Ваксмана в 1943 году стрептомицина — первого препарата, активного в отношении Mycobacterium tuberculosis [1].
Появление аминогликозидных антибиотиков ведет свое начало с открытия исследовательской группой Зельмана Ваксмана в 1943 году стрептомицина — первого препарата, активного в отношении Mycobacterium tuberculosis [1]. За столь выдающееся открытие Ваксман в 1952 году был удостоен Нобелевской премии, при вручении которой было отмечено, что «в отличие от открытия пенициллина профессором Александером Флемингом, которое было в значительной степени обусловлено случаем, получение стрептомицина было результатом длительного, систематического и неутомимого труда большой группы ученых».
Впоследствии на основе природных структур, продуцируемых различными представителями актиномицетов (природные антибиотики), и в ряду их полусинтетических производных была разработана большая группа антибактериальных препаратов, которые составили класс аминогликозидов. В настоящее время выделяют три поколения аминогликозидов (табл. 1). К первому поколению относят стрептомицин, неомицин, канамицин и мономицин, применение которых на современном этапе ограничено вследствие их токсичности. Второе поколение составляют гентамицин, тобрамицин, сизомицин и нетилмицин. Амикацин и исепамицин входят в третье поколение аминогликозидов.
Название данной группы антибиотиков обусловлено молекулярной структурой, в основе которой присутствуют аминосахара, связанные гликозидной связью с агликоновой частью молекулы (рис. 1).
Механизм действия аминогликозидов связан с необратимым угнетением синтеза белка на уровне рибосом у чувствительных к ним микроорганизмов. В отличие от других ингибиторов синтеза белка аминогликозидные антибиотики оказывают не бактериостатическое, а именно бактерицидное действие. Аминогликозиды II и III поколений обладают широким спектром антимикробного действия, в первую очередь, в отношении большинства грамотрицательных микроорганизмов семейства Enterobacteriaceae (Escherichia coli, Proteus spp., Klebsiella spp., Enterobacter spp., Serratia spp. и др.), а также неферментирующих грамотрицательных палочек (Pseudomonas aeruginosa, Acinetobacter spp.) [2, 3, 4]. Аминогликозиды также проявляют свою активность в отношении Staphylococcus aureus, кроме метициллинрезистентных штаммов (MR). Отдельные представители класса различаются между собой по активности и спектру действия. В частности, аминогликозиды I поколения (стрептомицин, канамицин) проявляют наибольшую активность в отношении M. tuberculosis, мономицин обладает эффективностью против некоторых простейших. Все аминогликозиды II и III поколения активны в отношении P. aeruginosa, при этом тобрамицин проявляет наивысшую активность. Сизомицин характеризуется большей активностью, чем гентамицин в отношении Proteus spp., Klebsiella spp., Enterobacter spp. (табл. 2).
Одним из наиболее эффективных аминогликозидов является амикацин, что связано с устойчивостью к действию ферментов, инактивирующих другие аминогликозиды, поэтому антибиотик может оставаться активным в отношении штаммов P. aeruginosa, устойчивых к тобрамицину, гентамицину и нетилмицину [2, 5, 12]. Другой представитель III поколения — изепамицин дополнительно активен в отношении Aeromonas spp., Citrobacter spp., Listeria spp. и Nocardia spp.
Все представители класса аминогликозидов неактивны в отношении S. pneumoniae, S. maltophilia, B. cepacia и анаэробов (Bacteroides spp., Clostridium spp. и др.). Более того, следует помнить, что резистентность S. pneumoniae, S. maltophilia и B. cepacia к аминогликозидам используется при идентификации этих микроорганизмов. Аминогликозиды in vitro активны в отношении шигелл, сальмонелл, легионелл, однако их назначение при данных инфекциях недопустимо, так как они клинически неэффективны в отношении возбудителей, локализованных внутриклеточно [2].
В ряде случаев аминогликозиды оказывают постантибиотический эффект, который зависит от штамма микроорганизма и концентрации препарата в очаге инфекции.
Все аминогликозиды характеризуются практически одинаковой фармакокинетикой (табл. 3). Молекулы антибиотиков являются высокополярными соединениями, в связи с чем плохо растворяются в липидах и при приеме внутрь практически не всасываются из желудочно-кишечного тракта (в системный кровоток поступает менее 2%). Вследствие этого основной путь введения аминогликозидов парентеральный (кроме неомицина). Связывание аминогликозидов с белками крови низкое и колеблется для разных антибиотиков от 0 до 30% (например, тобрамицин практически не связывается с белками). Время достижения Cmax при в/м введении составляет 1–1,5 ч. Аминогликозиды практически не подвергаются биотрансформации, выводятся почками путем клубочковой фильтрации в неизмененном виде, создавая высокие концентрации в моче. Скорость экскреции зависит от возраста, функции почек и сопутствующей патологии пациента (например, при лихорадке она увеличивается, с большой скоростью препарат элиминируется у наркоманов, с меньшей — у беременных, при понижении функции почек скорость экскреции значительно замедляется). Период полувыведения всех аминогликозидов у взрослых с нормальной функцией почек составляет 2–4 ч, при почечной недостаточности период может возрастать до 70 ч и более. Пиковые концентрации аминогликозидов варьируют у различных пациентов и зависят от массы тела, объема жидкости и жировой ткани, состояния пациента. Например, у пациентов с обширными ожогами, асцитом объем распределения аминогликозидов повышен. Наоборот, при дегидратации или мышечной дистрофии он уменьшается.
Аминогликозиды способны создавать высокие концентрации в органах с хорошим кровоснабжением: печени, легких, почках, напротив, низкие концентрации отмечаются в мокроте, бронхиальном секрете, желчи, грудном молоке. Аминогликозиды плохо проходят через гематоэнцефалический барьер, однако при воспалении мозговых оболочек их проницаемость увеличивается.
Учитывая особенности фармакокинетики аминогликозидов, а также потенциальную специфическую токсичность данного класса антибиотиков, необходимо правильно рассчитывать дозу применяемых препаратов. Доза аминогликозидов (не только у детей, но и у взрослых!) должна рассчитываться исходя из массы тела с обязательным учетом индивидуальных особенностей пациента (возраст, функция почек, локализация инфекции).
Факторами, определяющими дозу аминогликозидов, являются [2]:
Дозы у взрослых и детей старше 1 месяца: стрептомицин, канамицин, амикацин по 15–20 мг/кг/сутки в 1–2 введения; гентамицин, тобрамицин — 3–5 мг/кг/сутки в 1–2 введения; нетилмицин — 4–6,5 мг/кг/сутки в 1–2 введения.
Современная практика применения аминогликозидов предусматривает введение препарата 1 раз в сутки, что оправдано как с микробиологической точки зрения (дозозависимый, быстро наступающий бактерицидный эффект; длительный постантибиотический эффект), так и с клинической (меньшая токсичность аминогликозидов при однократном введении при аналогичной эффективности терапии) [2, 3]. В настоящее время однократное в сутки введение аминогликозидов применяется при большинстве показаний (исключение составляют эндокардит и менингит). При однократном введении аминогликозиды лучше всего вводить внутривенно капельно в течение 15–20 мин.
Чрезвычайно важно, что аминогликозиды характеризуются вариабельностью фармакокинетических показателей. При введении одинаковой дозы потенциально токсические уровни в крови (10–14 мкг/мл) для природных аминогликозидов могут быть обнаружены в среднем у 10% больных, концентрации ниже необходимых для адекватной терапии выявляются у 25% больных и более [3]. В этой связи наиболее предпочтительными являются полусинтетические препараты — амикацин и нетилмицин, обладающие наименьшей вариабельностью показателей. Кроме того, данной группе препаратов свойствен узкий коридор безопасности, т. е. незначительный разрыв между эффективным и токсическим уровнем концентраций в крови. В этой связи единственным средством оптимизации лечения аминогликозидами является постоянный фармакокинетический мониторинг, который позволяет исключать создание токсических или субтерапевтических уровней препарата в крови (табл. 4).
При проведении терапевтического мониторинга определяют: 1) пиковую концентрацию аминогликозидов в сыворотке крови — через 60 мин после внутримышечного введения препарата или через 15 мин после окончания внутривенного введения; 2) остаточную концентрацию — перед введением очередной дозы. Установление пиковой концентрации не ниже порогового значения свидетельствует о достаточности используемой дозы аминогликозида, при этом ее высокие уровни не представляют опасности для пациента. Величина остаточной концентрации, превышающая терапевтический уровень, свидетельствует о кумуляции препарата и об опасности развития токсических эффектов. В этом случае снижают суточную дозу или удлиняют интервал между разовыми дозами. При однократном введении всей суточной дозы достаточно определять только остаточную концентрацию [2].
Аминогликозиды относятся к препаратам с низким уровнем общей токсичности. Однако для них характерны специфические нежелательные реакции, а именно ото- и нефротоксичность. Частота развития этих реакций варьирует в зависимости от препарата. В клинических исследованиях было показано, что частота развития нефротоксических явлений при применении нетилмицина составляет 2,8%, амикацина — 8,5%, гентамицина — 11,1% и тобрамицина — 11,5% [9]. Ототоксические реакции наблюдаются у 2,3% пациентов, получавших нетилмицин, у 7,7%, получавших гентамицин, 9,7% — тобрамицин и 13,8% — амикацин [9]. Ототоксичность проявляется как в виде вестибулярных нарушений (чаще при применении стрептомицина, гентамицина, тобрамицина), так и в виде нарушения слуха (амикацин, нетилмицин). Нарушение слуха и поражение преддверно-улиткового нерва могут оказаться необратимыми, вероятность данных реакций возрастает с повышением дозы препарата, при длительных курсах лечения, у больных пожилого возраста и пациентов с исходными нарушениями функции слухового аппарата. Нарушения функции почек при применении аминогликозидов, напротив, чаще всего обратимы. Высокой нефротоксичностью обладает гентамицин, наиболее безопасными препаратами являются амикацин и нетилмицин. В ряде случаев применение аминогликозидов сопровождается нарушением нервно-мышечной проводимости, развитием парестезий, периферических нейропатий.
С точки зрения профилактики развития побочных реакций наибольшее значение имеет отмеченный ранее контроль основных фармакокинетических параметров, которые должны быть ограничены заданными пределами (табл. 3 и 4). Одновременное применение аминогликозидов с другими лекарственными препаратами, выводящимися из организма путем почечной экскреции, также относится к числу факторов риска, влияющих на частоту или степень проявления нежелательных реакций. Аминогликозиды не рекомендуется применять вместе с амфотерицином В, цисплатином, миорелаксантами и ванкомицином.
На протяжении длительного времени аминогликозиды относятся к широко применяемым антибактериальным препаратам и входят в стандарты лечения инфекций различной локализации (табл. 5). На современном этапе практическое значение данной группы антибиотиков, в первую очередь, связано с лечением нозокомиальных инфекций, вызываемых преимущественно грамотрицательными микроорганизмами. Основными показаниями к применению аминогликозидов II и III поколения являются тяжелые инфекции: сепсис, септический эндокардит, остеомиелит, инфекции кожи и мягких тканей, нозокомиальная пневмония, генерализованные формы раневой и ожоговой инфекции, перитонит, послеоперационные гнойные осложнения, инфекции почек и мочеполовых путей и др. В большинстве случаев аминогликозиды назначаются в комбинации с бета-лактамными и антианаэробными антибиотиками. Следует отметить, что в качестве средства эмпирической терапии может служить только амикацин, поскольку к нему сохраняют высокую чувствительность более 70% штаммов грамотрицательных бактерий. Назначение других аминогликозидов рекомендовано после подтверждения чувствительности к гентамицину или конкретному антибиотику выделяемых возбудителей.
Резистентность микроорганизмов к аминогликозидам
К сожалению, более чем полувековое использование аминогликозидов, в том числе по необоснованным показаниям (внебольничные инфекции дыхательных путей и пр.), привело к возникновению и распространению устойчивых к ним штаммов микроорганизмов [10]. В частности, в России уровень резистентности к аминогликозидам, прежде всего к гентамицину, превышает таковой в большинстве других стран [11].
Формирование устойчивости к аминогликозидам обусловлено в первую очередь ферментативной инактивацией антибиотиков путем модификации [11, 12]. Модифицированные молекулы теряют способность связываться с рибосомами и подавлять синтез белка микроорганизмов. Известны три группы аминогликозидмодифицирующих ферментов (АМФ): ацетилтрансферазы (ААС), присоединяющие молекулу уксусной кислоты, фосфортрансферазы (АРН), присоединяющие молекулу фосфорной кислоты, нуклеотидил- или аденилилтрансферазы (ANT), присоединяющие молекулу нуклеотида аденина (табл. 6). В целом именно гентамицин является субстратом для значительно большего количества АМФ, чем другие аминогликозиды II и III поколения, что определяет высокий уровень резистентности к данному антибиотику. Напротив, возможность модифицирования амикацина обуславливает наименьшее среди аминогликозидов количество АМФ, поэтому к нему сохраняют чувствительность ряд бактерий, резистентных к гентамицину, нетилмицину и другим препаратам этой группы.
Согласно данным по антибиотикорезистентности в России за период 2002–2004 гг., чрезвычайно высокая резистентность нозокомиальных штаммов P. aeruginosa и Klebsiella pneumoniae наблюдалась к гентамицину, составляя 74,9% и 76,5% соответственно — рис. 2, рис. 3 [13]. Наиболее активен в отношении данных возбудителей амикацин, к которому нечувствительны до 35,8% штаммов K. pneumoniae и 42,9% P. aeruginosa.
В другом же исследовании (Micromax), проведенном в стационарах Москвы, Смоленска и Екатеринбурга частота выделения нечувствительных к амикацину штаммов P. aeruginosa и K. pneumoniae составила 11% и 10,8% соответственно [14]. В этой связи чрезвычайно важно руководствоваться именно локальными данными по антибиотикорезистентности возбудителей.
Применение аминогликозидов в лечении инфекций дыхательных путей
В связи с тем, что аминогликозиды не обладают активностью в отношении основного возбудителя внебольничных инфекций дыхательных путей — S. pneumoniae, их нельзя использовать для лечения внебольничной пневмонии (как в амбулаторной, так и стационарной практике) и других внебольничных инфекций верхних и нижних отделов респираторного тракта. Пожалуй, единственной клинической ситуацией, оправдывающей назначение аминогликозидов, является тяжелая внебольничная пневмония, вызванная P. aeruginosa. В данном случае применяются цефтазидим, цефепим, цефоперазон/сульбактам, тикарциллин/клавуланат, пиперациллин/тазобактам, карбапенемы (меропенем, имипенем) или ципрофлоксацин либо в режиме монотерапии или комбинации с аминогликозидами II–III поколения (предпочтительным является применение амикацина) [15].
Абсцесс легкого и эмпиема плевры
Потенциальными возбудителями абсцесса легкого являются анаэробные микроорганизмы — Fusobacterium nucleatum, Peptostreptococcus spp., Bacteroides spp. либо ассоциации анаэробных и аэробных бактерий (в первую очередь, представители семейства Enterobacteriacea — K. pneumoniae и K. оxytoca) [16]. Российские эксперты в качестве препаратов выбора рекомендуют применение ингибиторозащищенных аминопенициллинов (амоксициллин/клавуланат, ампициллин/сульбактам) либо цефоперазон/сульбактама. При отсутствии этих антибиотиков либо их неэффективности могут использоваться карбапенемы, ингибиторозащищенные пенициллины (тикарциллин/клавуланат, пиперациллин/тазобактам) либо комбинации клиндамицина с аминогликозидами II и III поколения [17].
В этиологии эмпиемы плевры ведущую роль занимают грамотрицательные бактерии (15–32%) и анаэробы (5–19%). На долю S. aureus приходится от 7 до 15% случаев, S. pneumoniae выделяется у 5–7% больных, еще реже встречается H. influenzae. В 20–25% случаев обнаруживают микробные ассоциации, прежде всего, анаэробов и аэробов, представленных грамотрицательными бактериями [18]. Антибактериальная терапия должна, по возможности, проводится целенаправленно, т. е. с учетом данных микробиологического исследования содержимого плевральной полости. При острой постпневмонической эмпиеме плевры, вызванной S. pneumoniae и S. pyogenes, в качестве препаратов выбора используются цефалоспорины ІІ–ІV поколений в режиме монотерапии. Альтернативой им являются линкосамиды или ванкомицин. При стафилококковой острой постпневмонической эмпиеме применяют оксациллин либо цефазолин, в качестве альтернативы рассматриваются линкосамиды, фузидиевая кислота, ванкомицин и линезолид. В случае острой постпневмонической эмпиемы плевры, вызванной Haemophilus influenzae, препаратами выбора являются цефалоспорины III или IV поколения. Альтернативой им являются «защищенные» аминопенициллины (амоксициллин/клавуланат, ампициллин/сульбактам) или фторхинолоны.
В этиологии подострой и хронической эмпиемы плевры ведущую роль занимают анаэробные стрептококки, бактероиды, часто в ассоциации с микроорганизмами семейства Enterobacteriaceae. Препаратами первой линии в данном случае являются «защищенные» аминопенициллины — амоксициллин/клавуланат или ампициллин/сульбактам. В качестве препаратов альтернативы рекомендуются линкосамид в сочетании с аминогликозидом II или III поколения, либо цефалоспорины II–IV генерации, либо карбапенемы (имипенем, меропенем), либо тикарциллин/клавуланат или пиперациллин/тазобактам [17]. При эмпиеме плевры, как правило, без хирургического вмешательства невозможно добиться излечения пациента, и в большинстве случаев требуется торакотомическое дренирование, реже применяется торакоскопия и декортикация.
Нозокомиальная пневмония
Нозокомиальная пневмония (НП) занимает второе место среди всех нозокомиальных инфекций (13–18%) и является самой частой инфекцией (≥ 45%) в отделениях реанимации и интенсивной терапии (ОРИТ) [19, 23]. НП развивается в среднем у 0,5–1% всех госпитализированных больных и у 10–20% госпитализированных в ОРИТ. Особая категория НП у пациентов, находящихся на искусственной вентиляции легких (вентиляторассоциированная пневмония — ВАП), развивается у 9–27% от общего числа интубированных. По показателю смертности НП лидирует среди нозокомиальных инфекций, вызывая летальные исходы в среднем от 30 до 70% пациентов [20, 21].
НП наиболее часто вызывается аэробными грамотрицательными микроорганизмами — P. aeruginosa, E. coli, K. pneumoniae и Acinetobacter spp. (рис. 4). В последнее время отмечается увеличение частоты обнаружения S. aureus, в том числе МR (MRSA) [21]. Большинство случаев НП имеет полимикробную этиологию [22]. Частота встречаемости полирезистентных возбудителей зависит от популяции пациентов (чаще всего у больных с тяжелыми хроническими заболеваниями, факторами риска развития пневмонии и поздним развитием пневмонии > 5 дней), стационара и типа отделения, что свидетельствует о крайней необходимости получения локальных данных.
При выборе антибиотиков для эмпирической антибактериальной терапии НП необходимо ориентироваться в первую очередь на локальные данные по антибиотикорезистентности возбудителей. Необходимо помнить, что эти данные нуждаются в периодическом обновлении, так как устойчивость бактерий может изменяться с течением времени в зависимости от структуры и частоты использования антибиотиков.
В настоящее время рекомендован подход к антибиотикотерапии НП в зависимости от сроков развития заболевания. При ранней НП (≤ 5 дней), развившейся у пациентов без факторов риска, применяют цефалоспорины III и IV поколения, амоксициллин/клавуланат, левофлоксацин, моксифлоксацин, ципрофлоксацин и эртапенем в режиме монотерапии.
Напротив, у пациентов с поздней (> 5 дней) НП или при наличии факторов риска полирезистентных возбудителей рекомендована комбинированная терапия — антисинегнойный цефалоспорин или карбапенем или цефоперазон/сульбактам в сочетании с амикацином или фторхинолоном с синегнойной активностью.
Аминогликозиды также применяются в комбинации с карбапенемом при НП установленной этиологии, в частности, вызванной E. coli, K. pneumoniae, другими грамотрицательными микро-
организмами (Enterobacter spp., Morganella spp., Serratia spp.), P. aeruginosa или Acinetobacer spp. (табл. 7).
Традиционная длительность терапии НП составляет 14–21 день, однако современная тактика ведения пациентов с ВП предусматривает сокращение длительности антибиотикотерапии до 7 дней в случае эффективной начальной эмпирической терапии [21]. При использовании аминогликозидов для комбинированной эмпирической терапии, их применение может быть прекращено через 5–7 дней у пациентов с клинической эффективностью лечения.
В заключение необходимо еще раз отметить, что применение аминогликозидов для лечения внебольничных инфекций дыхательных путей недопустимо, при внутрибольничных инфекциях аминогликозиды (нетилмицин, амикацин) должны использоваться только лишь в определенных клинических ситуациях и только в комбинации с другими антибактериальными препаратами.