Что лучше габапентин или мидокалм
Лечение невропатических болевых синдромов в практике врача-невролога
Н.В. ТАРАРОЩЕНКО, заведующий неврологическим отделением Центральной городской больницы № 14 г. Донецка
Пациенты с разнообразными вариантами боли встречаются в нашей практике ежедневно. Как важно для врача после осмотра пациента четко определиться с генезом болевых ощущений, ведь от этого подчас зависит выбор правильного и адекватного лечения.
Врач-невролог, как никто другой, должен хорошо знать, что такое боль и какие ее типы существуют.
Все болевые ощущения подразделяются на две большие разновидности: ноцицептивная (или соматогенная) и невропатическая (или неврогенная).
В определенных случаях имеет место сочетание ноцицептивного и невропатического компонентов боли (при компрессионных радикулопатиях).
Самыми частыми ситуациями, при которых встречается невропатическая боль, являются:
Примеры невропатической боли:
Частота невропатической боли:
Среди всех пациентов с невропатической болью около 50 % составляют больные с диабетической полиневропатией. К сожалению, нередко боли у этих пациентов трактуются как сосудистые или вертеброгенные, что приводит к неадекватным терапевтическим мероприятиям.
Особенностью невропатической боли является ассоциированность со специфическими чувствительными расстройствами:
При гиперальгезии чувствительность к болевому стимулу оказывается значительно выше, чем ожидается в норме.
При гиперпатии субъективный ответ как на болевой, так и неболевой стимул является чрезмерным и часто сохраняется в течение долгого времени уже после прекращения раздражения.
Невралгии (тригеминальная, постгерпетическая) являются типичным примером невропатической боли.
Спонтанная боль возникает при очевидном отсутствии какого-либо внешнего воздействия; как правило, носит жгучий, колющий характер.
Невропатическая боль возникает в результате нарушенного взаимодействия ноцицептивных и антиноцицептивных систем вследствие их поражения или нарушения функций на различных уровнях нервной системы. Наиболее изучена роль периферических нервов, корешков, заднего рога спинного мозга, нейротрансмиттеров боли, глутаматных рецепторов, натриевых и кальциевых каналов.
Возможные механизмы боли включают спонтанную эктопическую активность поврежденных аксонов, сенситизацию болевых рецепторов, патологические взаимодействия периферических сенсорных волокон, гиперчувствительность к катехоламинам.
Центральная сенситизация группы нейронов спинного мозга является результатом нейрональной пластичности, активированной первичной афферентной стимуляцией. Этот процесс считается решающим в формировании синдрома невропатической боли и приводит к развитию аллодинии и гиперпатии.
Вольтажзависимые кальциевые N-каналы расположены в поверхностной пластинке заднего рога спинного мозга и участвуют в формировании невропатической боли. Полагают, что субъединица α2δ, входящая в состав всех вольтажзависимых кальциевых каналов, является мишенью для антиаллодинического действия габапентина.
Методы лечения невропатической боли можно разделить на две большие группы: немедикаментозные и медикаментозные.
Немедикаментозные методы, усиливающие активность антиноцицептивных систем:
Выбор фармакологической терапии при спастическом мышечном гипертонусе
Основными препаратами, используемыми для снижения мышечного тонуса, являются миорелаксанты. Рассмотрены вопросы выбора терапии с использованием антиспастических препаратов в зависимости от заболевания, выраженности мышечной спастичности, побочных эффектов
Myorelaxants are the basic preparations used for reduction in the muscular tone. Issues of selection of therapy by anti-spastic preparations depending on the disease, manifestation of muscular spasticity, side effects and special features of the preparation effect are considered.
Основными препаратами, используемыми для снижения мышечного тонуса, являются миорелаксанты. По механизму действия различают миорелаксанты центрального действия (влияют на синаптическую передачу возбуждения в центральной нервной системе) и периферического действия (угнетают прямую возбудимость поперечно-полосатых мышц). При применении миорелаксантов могут возникать достаточно значимые побочные действия, которые при выборе препарата надо тщательно оценивать [1, 2].
При выборе антиспастических препаратов учитывают в основном их способность тормозить полисинаптические рефлексы (уменьшение спастики), оказывая при этом наименьшее влияние на моносинаптические рефлексы (сила мышц). Антиспастический препарат должен уменьшать мышечную спастичность при минимальном снижении мышечной силы [3, 4].
Медикаментозная терапия основана на использовании таблетированных и инъекционных форм. Применяемые внутрь антиспастические средства, уменьшая мышечный тонус, могут улучшить двигательные функции, облегчить уход за обездвиженным пациентом, снять болезненные мышечные спазмы, усилить действие лечебной физкультуры, предупредить развитие контрактур [5]. При легкой степени спастичности применение миорелаксантов может привести к значительному положительному эффекту, однако при выраженной спастичности могут потребоваться большие дозы миорелаксантов, применение которых нередко вызывает нежелательные побочные эффекты. Лечение миорелаксантами начинают с минимальной дозы, затем ее медленно повышают для достижения эффекта [6].
К миoрелаксантам центрального действия, наиболее часто используемым в России для лечения спастического мышечного гипертонуса, относятся баклофен, тизанидин, толперизон, диазепам [7, 8].
Баклофен (Баклосан, Лиорезал) оказывает антиспастическое действие преимущественно на спинальном уровне. Препарат представляет аналог гамма-аминомасляной кислоты (ГАМК), который связывается с пресинаптическими ГАМК-рецепторами, приводя к уменьшению выделения возбуждающих аминокислот (глутамата, аспартата) и подавлению моно- и полисинаптической активности на спинальном уровне, что и вызывает снижение спастичности. Препарат проявляет также умеренное центральное анальгезирующее действие. Баклофен используется при спинальном и церебральном спастическом мышечном гипертонусе различного генеза. Начальная доза составляет 5–15 мг/сут (в один или три приема), затем дозу увеличивают на 5 мг каждый день до получения желаемого эффекта. Препарат принимают во время еды. Максимальная доза баклофена для взрослых составляет 60–75 мг/сут. Побочные эффекты чаще проявляются седацией, сонливостью, снижением концентрации внимания, головокружением и часто ослабевают в процессе лечения. Возможно возникновение тошноты, запоров и диареи, артериальной гипертонии, усиление атаксии, появление парестезий. Требуется осторожность при лечении больных пожилого возраста, пациентов, перенесших инсульт, пациентов с язвенной болезнью желудка и двенадцатиперстной кишки. Баклофен противопоказан при эпилепсии, наличии судорог в анамнезе [9, 10].
При выраженной спастичности, когда обычное пероральное применение антиспастических препаратов не эффективно, показано интратекальное введение баклофена, которое впервые было предложено в 1984 г. R. Penn. Для достижения необходимой концентрации препарата в спинномозговой жидкости необходимо принимать довольно значительные дозы баклофена, что может привести к нарушениям сознания, сонливости, слабости. В связи с этим были разработаны системы, при помощи которых баклофен доставляется непосредственно в подоболочечное пространство спинного мозга при помощи подоболочечной баклофеновой насосной системы. При этом клинического эффекта добиваются гораздо меньшими дозами баклофена, чем при использовании таблетированных форм [11, 12].
Данная система состоит из резервуара, где содержится баклофен или аналогичный препарат, насоса (помпы), при помощи которого препарат дозированно подается в подоболочечное пространство спинного мозга через люмбальный катетер и блока питания. Из резервуара баклофен поступает непосредственно в спинномозговую жидкость, а его дозировка контролируется специальным радиотелеметрическим устройством. Количество поступающего в спинномозговую жидкость лекарственного препарата можно изменять в зависимости от клинической картины. Добавление баклофена в резервуар производится через 2–3 месяца при помощи чрезкожной пункции [13].
Использование баклофеновой помпы улучшает скорость и качество ходьбы больных с нефиксированными рефлекторными контрактурами, обусловленными высокой спастичностью мышц-синергистов и дисбалансом мышц-антагонистов. Имеющийся 15-летний клинический опыт применения баклофена интратекально у больных, перенесших инсульт, свидетельствует о высокой эффективности этого метода в уменьшении не только степени спастичности, но и болевых синдромов и дистонических расстройств. Отмечено положительное влияние баклофеновой помпы на качество жизни больных, перенесших инсульт [14].
Тизанидин (Сирдалуд) — миорелаксант центрального действия, агонист альфа-2-адренергических рецепторов. Препарат снижает спастичность вследствие подавления полисинаптических рефлексов на уровне спинного мозга, что может быть вызвано угнетением высвобождения возбуждающих аминокислот L-глутамата и L-аспартата и активацией глицина, снижающего возбудимость интернейронов спинного мозга. Тизанидин обладает также умеренным центральным анальгетическим действием. Препарат эффективен при церебральной и спинальной спастичности, а также при болезненных мышечных спазмах. Начальная доза препарата составляет 2–6 мг/сут в один или три приема, при индивидуальном подборе увеличение дозы происходит на 3–4 день на 2 мг. При пероральном приеме действие препарата проявляется через 30–45 минут, максимальный эффект наступает в течение 1–2 часов. Средняя терапевтическая доза составляет 12–24 мг/сут, максимальная доза — 36 мг/сут. В качестве побочных эффектов могут возникнуть сонливость, сухость во рту, головокружение и снижение артериального давления, что ограничивает использование препарата при постинсультной спастичности. Антиспастический эффект тизанидина сопоставим с эффектом баклофена, однако тизанидин при адекватном подборе дозировки лучше переносится, т. к. не вызывает общей мышечной слабости и не усиливает мышечную слабость в парализованной конечности [15, 16].
Толперизон (Мидокалм) — антиспастический препарат центрального действия, угнетает каудальную часть ретикулярной формации и обладает Н-холинолитическими свойствами. Толперизон снижает активность спинальных нейронов, участвующих в формировании спастичности, путем ограничения потока натрия через мембрану нервных клеток. Наиболее часто используется по 300–450 мг/сут в два или три приема. Снижение мышечного тонуса при назначении толперизона иногда сопровождается сосудорасширяющим действием, что следует учитывать при назначении больным с тенденцией к артериальной гипотонии. Также препарат может вызывать или усиливать у больных недержание мочи [17].
Основным побочным эффектом баклофена, тизанидина и толперизона является быстрое наступление мышечной слабости, причем в каждом случае врач должен находить баланс между снижением тонуса и усилением слабости. Кривая баланса между снижением спастического тонуса и усилением мышечной слабости у больных на фоне увеличения дозы Мидокалма, Сирдалуда или Баклофена показывает, что наиболее быстрое усиление слабости происходит при приеме Баклофена, а самый мягкий препарат, позволяющий эффективно подобрать индивидуальную дозировку, — Мидокалм. Во всех случаях, учитывая наличие узкого терапевтического окна, курс лечения начинают с небольшой дозы препарата, постепенно наращивая ее до достижения отчетливого антиспастического эффекта, но не до появления слабости [18, 19].
Диазепам (Реаланиум, Релиум, Сибазон) является миорелаксантом, поскольку обладает способностью стимулировать уменьшенное пресинаптическое торможение на спинальном уровне. Он не имеет прямых ГАМК-ергических свойств, увеличивает концентрацию ацетилхолина в мозге и тормозит обратный захват норадреналина и дофамина в синапсах. Это приводит к усилению пресинаптического торможения и проявляется снижением сопротивляемости растяжению, увеличением диапазона движений. Диазепам также обладает способностью уменьшать болевой синдром, вызываемый спазмом мышц. Наряду со снижением мышечного тонуса, развиваются заторможенность, головокружение, нарушение внимания и координации ввиду токсического действия на центральную нервную систему. Это значительно ограничивает применение диазепама в качестве миорелаксанта. Используется он, в основном, для лечения спастичности спинального происхождения при необходимости кратковременного снижения мышечного тонуса. Для лечения спастичности назначают в дозе 5 мг однократно или по 2 мг 2 раза в день. Максимальная суточная доза может составлять 60 мг. При больших дозах могут отмечаться расстройства сознания, преходящая дисфункция печени и изменения крови. Продолжительность лечения ограничена из-за возможного развития лекарственной зависимости [20].
Клоназепам является производным бензодиазепина. Клоназепам оказывает успокаивающее, центральное миорелаксирующее, анксиолитическое действие. Миорелаксирующий эффект достигается за счет усиления ингибирующего действия ГАМК на передачу нервных импульсов, стимуляции бензодиазепиновых рецепторов, расположенных в аллостерическом центре постсинаптических ГАМК-рецепторов восходящей активирующей ретикулярной формации ствола головного мозга и вставочных нейронов боковых рогов спинного мозга, а также уменьшения возбудимости подкорковых структур головного мозга и торможения полисинаптических спинальных рефлексов.
Быстрое наступление сонливости, головокружения и привыкания ограничивает применение этого препарата. Для снижения проявления возможных побочных реакций, достигать терапевтической дозы необходимо путем медленного титрования в течение двух недель. Для приема внутрь взрослым рекомендуется начальная доза не более 1 мг/сут. Поддерживающая доза — 4–8 мг/сут. Возможно назначение небольших доз в сочетании с другими миорелаксантами. Клоназепам эффективен при пароксизмальных повышениях мышечного тонуса. Противопоказан при острых заболеваниях печени, почек, миастении [21].
Дикалия клоразепат (Транксен) — аналог бензодиазепина, трансформируется в главный метаболит диазепама, обладает большей активностью и длительностью антиспастического действия, чем диазепам. Отмечен его хороший эффект при лечении в виде уменьшения фазических рефлексов на растяжение, обладает незначительным седативным эффектом. Первоначальная доза составляет 5 мг 4 раза в сутки, затем уменьшается до 5 мг 2 раза в сутки [22].
Дантролен — производное имидазолина, действует вне центральной нервной системы, преимущественно на уровне мышечных волокон. Механизм действия дантролена — блокирование высвобождения кальция из саркоплазматического ретикулума, что ведет к снижению степени сократимости скелетных мышц, редукции мышечного тонуса и фазических рефлексов, увеличению диапазона пассивных движений. Важным преимуществом дантролена по отношению к другим миорелаксантам является его доказанная эффективность в отношении спастичности не только спинального, но и церебрального генеза. Начальная доза — 25 мг/сут, при переносимости дозу увеличивают в течение 4 недель до 400 мг/сут. Побочные эффекты — сонливость, головокружение, тошнота, диарея, снижение скорости клубочковой фильтрации. Серьезную опасность, особенно у пожилых пациентов в дозе более 200 мг/сут, представляет гепатотоксическое действие, поэтому в период лечения надо регулярно следить за функцией печени. Элиминация дантролена на 50% осуществляется за счет печеночного метаболизма, в связи с этим он противопоказан при заболеваниях печени. Осторожность следует соблюдать и при тяжелых сердечных или легочных заболеваниях.
Катапресан — применяется в основном при спинальных повреждениях, действует на альфа-2-агонисты головного мозга, обладает пресинаптическим торможением. Из побочных эффектов отмечаются снижение артериального давления и депрессия. Первоночальная доза — 0,05 мг 2 раза в день, максимальная — 0,1 мг 4 раза в день.
Темазепам — взаимодействует с бензодиазепиновыми рецепторами аллостерического центра постсинаптических ГАМК-рецепторов, расположенных в лимбической системе, восходящей активирующей ретикулярной формации, гиппокампе, вставочных нейронах боковых рогов спинного мозга. В результате открываются каналы для входящих токов ионов хлора и таким образом потенцируется действие эндогенного тормозного медиатора — ГАМК. Рекомендуемая доза — 10 мг 3 раза в день. Эффективно его сочетание с баклофеном [23, 24].
Основные лекарственные средства, используемые для лечения спастического мышечного гипертонуса, представлены в табл.
Таким образом, выбор препарата определяется основным заболеванием, выраженностью мышечной спастичности, а также побочными эффектами и особенностями действия конкретного препарата.
Так, например, тизанидин и баклофен в большей степени действуют на тонус мышц-разгибателей, поэтому в случаях наличия значительного гипертонуса мышц-сгибателей руки, легкой спастичности мышц ноги их прием не показан, поскольку легкое повышение тонуса мышц-разгибателей ноги компенсирует мышечную слабость в ноге и стабилизирует походку больного. В таком случае средством выбора являются методы физического воздействия на мышцы верхней конечности.
При лечении церебральной спастичности наиболее часто применяют Сирдалуд, а при спинальной спастичности — Сирдалуд и Баклофен. Важным преимуществом перед другими миорелаксантами обладает Мидокалм, который не оказывает седативного эффекта и имеет благоприятный спектр переносимости, поэтому является препаратом выбора для лечения в амбулаторных условиях и для лечения пожилого контингента пациентов.
Допустима комбинация нескольких средств, что позволяет эффективно снижать тонус на меньших дозах каждого из препаратов. Сочетание препаратов с разными точками приложения, начиная от центров в головном мозге и до мышц, может привести к суммированию терапевтического эффекта.
Эффективность пероральных антиспастических препаратов снижается при их длительном использовании, часто возникает необходимость возрастающего повышения дозировок для поддержания начального клинического эффекта, что сопровождается увеличением частоты и тяжести побочных реакций [25–27].
В ситуации, когда спастичность носит локальный характер и системный эффект пероральных миорелаксантов нежелателен, предпочтительны локальные методы воздействия, одним из которых является локальное введение ботулотоксина [28, 29].
Литература
А. А. Королев, кандидат медицинских наук
ФГБУ «Всероссийский центр экстренной и радиационной медицины им. А. М. Никифорова» МЧС России, Санкт-Петербург
Невропатический болевой синдром при болях в спине
Опубликовано в журнале:
«Трудный пациент», 2011, ТОМ 9, № 1, с. 17-23
А.Н.Баринов
Первый Московский Государственный Медицинский Университет им. И.М.Сеченова
По своему биологическому происхождению боль можно расценивать в качестве «парламентера болезни», выдвигающего сознанию ультиматум об опасности и неблагополучии в организме, направленный на мобилизацию защитных процессов, восстановление поврежденной ткани и нормальной жизнедеятельности. Без сохранности восприятия боли существование человека и животных невозможно: боль формирует целый комплекс защитных реакций, направленных на устранение повреждения [1].
Различают острую (длящуюся до 10 дней) и хроническую (продолжающуюся более 3-х месяцев) боль, механизмы развития которых принципиально различаются. Если в основе острых болей лежит, чаще всего, реальное повреждение тканей организма (травма, воспаление, инфекционный процесс), то в генезе хронической боли на первый план выходят изменения в центральной нервной системе, вызванные длительным непрекращающимся потоком болевой импульсации от поврежденного органа. Таким образом, при хронической боли часто наблюдается ситуация, когда реальное повреждение тканей уже отсутствует, а боль продолжается, как бы «оторвавшись» от первоначальной причины болезни, и став самостоятельным заболеванием.
Традиционно считается, что лечение боли должно в первую очередь воздействовать на этиологические факторы, например, компенсацию разницы длины ног, лечение дегенеративных изменений хряща фасеточных суставов, удаление грыжи межпозвоночного диска и так далее, однако этиотропная терапия часто не прекращает ни острую, ни хроническую боль. Это связано с тем, что в основе острых болей, чаще всего, лежит воспаление, а это значит, что необходимы противовоспалительные препараты для быстрого купирования болевого синдрома. Основой же хронических болей являются изменения в центральной и периферической нервной системе (периферическая и центральная сенситизация, снижение нисходящих ингибирующих влияний антиноцицептивной системы), которые, как бы «отрывают» боль от первопричины заболевания, делая ее самостоятельной болезнью.
Необходимо отметить, что НСПВС не рекомендуются для применения более 10-14 дней. Если недельный курс приема препарата не купирует болевой синдром, то это должно побудить врача пересмотреть тактику лечения с привлечением невролога, который поможет разобраться в структуре болевого синдрома с целью выявления признаков «серьезной патологии» и выяснить причины неэффективности НСПВС в каждом конкретном случае. А причин такой неэффективности может быть несколько: плохое кровоснабжение в очаге воспаления (тогда противовоспалительный препарат можно ввести адресно прямо в эпицентр боли и воспаления путем блокады с местными анестетиками под ультразвуковым или рентгеноскопическим контролем) или стойкий спазм паравертебральных мышц с формированием порочного круга «боль-спазм-боль». При мышечно-тонических болевых синдромах и при хронификации боли в спине НСПВС становятся не эффективны в качестве монотерапии. Они просто не способны «успокоить» расторможенные отделы нервной системы.
При отсутствии противопоказаний желательно дополнить лечение немедикаментозной терапией: тепловыми физиопроцедурами, мануальной терапией, вакуумным и ручным массажем [1, 6]. В некоторых случаях релаксации паравертебральных мышц и восстановление микроциркуляции в миофасциальных триггерных зонах удается достичь без дополнительного медикаментозного воздействия при применении вышеуказанных физиотерапевтических методов и ударно-волновой терапии.
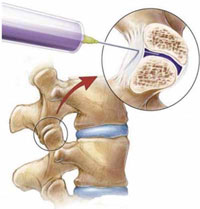
Дополнительным и наиболее эффективным консервативным методом терапии скелетно-мышечных болей в спине на любом этапе лечения оказывается локальное инъекционное введение (блокада) кортикостероидов (например, бетаметазона) в очаг воспаления или дегенеративно-дистрофического процесса (рис. 1). Такой способ введения применяется для глюкокортикоидов (эпидурально, фораминально, параартикулярно в фасеточные суставы, в миофасциальные триггерные точки и др.) и местных анестетиков [6, 8]. Однако проведение блокад требует наличия специальных навыков у врача, осуществляющего эту процедуру, а также дорогостоящей аппаратуры, обеспечивающей правильное попадание иглы в пораженную область (рентгенографической установки с электронно-оптическим преобразователем или ультразвукового сканера), поэтому методика блокад пока не распространена повсеместно.
Рис. 1. Блокада фасеточного сустава.
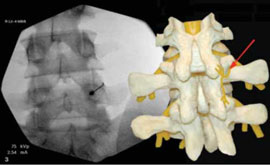
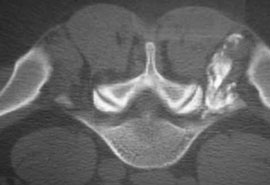
Рис. 2. Денервация фасеточного сустава L4-L5 слева
Примечание. Стрелкой показан коагулируемый фасеточный нерв.
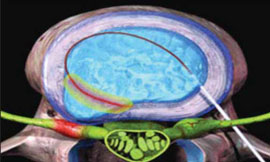
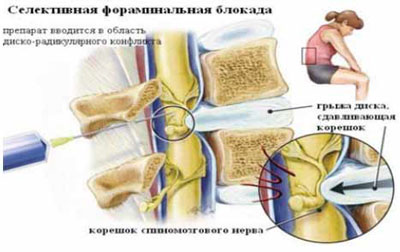
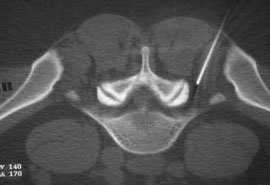
Таким же образом определяется прогноз эффективности внутридисковой электротермической аннулопластики (рис. 3), лазерной вапоризации или холодноплазменной аблации межпозвонкового диска при радикулопатии. Если интрафораминальное введение анестетика под контролем компьютерной томографии (рис. 4) устраняет болевой синдром, то проведение вышеуказанных малоинвазивных пункционных нейрохирургических воздействий также будет эффективным [7].
Рис. 3. Внутридисковая радиочастотная электротермическая аннулопластика
Рис. 4. Селективная фораминальная блокада
А. Схема проведения блокады
Б. Введение иглы в межпозвонковое отверстие под КТ-контролем
В. Введение раствора анестетика с рентгенконтрастным препаратом (омнипак)
Вопрос о проведении пункционных или открытых нейрохирургических вмешательств при болях в спине ставится в случае неэффективности правильно проводимой консервативной терапии в течение 3 мес [1, 6]. К сожалению, нередко оперативное вмешательство проводится при отсутствии должных показаний (прогрессирующий парез иннервируемых пораженным корешком мышц конечности, тазовые нарушения, перемежающаяся хромота, вызванная стенозом позвоночного канала), что чревато формированием хронического постдискэктомического болевого синдрома, обусловленного множеством факторов (нарушением биомеханики движения в оперированном сегменте позвоночника, спаечным процессом, хроническим эпидуритом и т. п.).
Ограничивающим фактором применения антидепрессантов и антиконвульсантов первого поколения (например, карбамазепина) в лечении радикулопатии является наличие выраженных побочных явлений (сонливость, потеря координации движений, повышение артериального давления, задержка мочи и т. д.) и синдрома отмены (возобновление болей, развитие тревоги, психомоторного возбуждения и даже судорожных припадков при резком прекращении приема этих лекарств). К дополнительным недостаткам антидепрессантов можно отнести нелинейность фармакокинетики, т.е. при приеме небольших доз концентрация вещества в плазме может быть больше, чем при приеме больших доз.
Продолжительность лечения препаратом Габагамма (габентин) пациентов с радикулопатией нейропатического генеза составляет в среднем 6 нед с последующей медленной отменой препарата. Начальная доза препарата составляет 300 мг/сут с дальнейшим титрованием дозы (табл. 1) до 1800 мг/сут.
Таблица 1. Подбор дозы препарата Габагамма (габапентин) в стандартных случаях
Начальное титрование дозы (первая неделя)
Таблица 2. Подбор дозы препарата Габагамма (габапентин) у крупных пациентов
| Начальное титрование дозы (1-я неделя) | Коррекция дозы | ||||
| Доза | 1-й день | 2-й день | 3-й день | доза | 2-я неделя |
| 1200 мг | 400 мг 1 раз в день | 400 мг 2 раза в день | 400 мг З раза в день | 2400 мг | 800 мг З раза в день |
Таким образом, Габагамма (габапентин) обладает большим потенциалом для лечения невропатического болевого синдрома при радикулопатиях в комбинации с другими методами лечения.
Анализ литературных данных, касающихся диагностики и лечения боли, а также наш собственный клинический опыт показывают, что ни один из отдельно применяющихся методов хирургического, фармакологического, физического или психологического лечения хронической боли не может сравниться по своей эффективности с многопрофильным подходом, применяющимся в специализированных клиниках боли, когда все вышеуказанные методы, назначенные вместе в одном комплексе, взаимно усиливают (потенцируют) друг друга. При этом риск возникновения побочных явлений существенно снижается за счет снижения доз и сокращения курса приема аналгетиков.
_575.gif)