Что лучше кетанов или кетонал после операции
Преимущества Кетонала при лечении пожилых пациентов с остеоартрозом и сопутствующей артериальной гипертонией
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
О стеоартроз (ОА) – одно из основных дегенеративных заболеваний суставов, которое характеризуется хроническим прогрессирующим течением. ОА занимает первое место по распространенности среди ревматических болезней. ОА встречается у каждого третьего пациента в возрасте от 45 до 64 лет и у 60–70% – старше 65 лет, причем чаще у женщин.
В комплексной терапии ОА широко используются нестероидные противовоспалительные препараты (НПВП), что связано не только с их антивоспалительным эффектом, но и отчетливым анальгетическим действием. Боль является одним из основных проявлений ОА, а купирование боли позволяет не только улучшить самочувствие больных, но и увеличить подвижность пораженных суставов. Многие пациенты с ОА принимают НПВП почти постоянно, т.к. эти средства обладают быстрым и выраженным анальгетическим эффектом и позволяют больным сохранять повседневную активность.
Одним из препаратов, нашедшим широкое применение в лечении остеоартроза, является кетопрофен (Кетонал) – производное пропионовой кислоты. При приеме внутрь Кетонал быстро и максимально полно абсорбируется в желудочно–кишечном тракте, максимальная концентрация в плазме крови достигается через 1,5–2 часа. Препарат хорошо проникает в синовиальную жидкость и соединительную ткань. Кетонал обладает коротким периодом полураспада и быстро выводится из организма; эти свойства позволяют рекомендовать препарат пожилым больным без боязни повышения риска побочных реакций.
По своей противовоспалительной активности кетопрофен близок к «золотому стандарту» НПВП – диклофенаку, тогда как по анальгетическому эффекту превосходит диклофенак и индометацин. Мощный болеутоляющий эффект Кетонала связывают с центральным воздействием, которое реализуется на уровне задних рогов спинного мозга. Кроме того, препарат оказывает непосредственное влияние на таламические центры болевой чувствительности, которое связано, по–видимому, с угнетением синтеза простагландинов в центральной нервной системе.
Кетонал обладает «сбалансированной» подавляющей активностью в отношении ЦОГ–1 и ЦОГ–2, что позволяет оптимально сочетать высокую эффективность и хорошую переносимость. Использование препарата не ассоциируется с тяжелыми аллергическими реакциями со стороны кожи и слизистых, а общее число побочных проявлений сравнимо с таковыми при использовании селективных ингибиторов ЦОГ–2.
Материалы и методы
Нами проведено открытое клиническое исследование эффективности и переносимости кетопрофена (Кетонал форте, «Лек», Словения) 300 мг/сут у больных ОА в сравнении с диклофенаком (Ортофен, «Нижфарм») 150 мг/сут. Оба НПВП назначались случайным способом 61 пациенту с достоверным ОА согласно критериям Американской коллегии ревматологов. Кетонал форте назначался в виде таблеток по 100 мг три раза в день, Ортофен – в виде таблеток по 25 мг в суточной дозе 150 мг. Исследуемые препараты назначались в течение 14 дней после 3–дневного отмывочного периода (отмены ранее принимаемых НПВП).
В зависимости от назначаемого НПВП больные были разделены на 2 группы. I группа, получавшая Кетонал, представлена 30 пациентами (25 женщин, 5 мужчин), средний возраст которых составил 55,1 года, длительность заболевания – от 0,5 до 20 лет, в среднем – 5,1 года. II группа, получавшая Ортофен, включала 31 больного (26 женщин и 5 мужчин), средний возраст которых составил 52 года, длительность заболевания – от 0,5 до 8 лет (в среднем – 2,3 года). Эффективность терапии НПВП оценивалась в двух точках, через 7 и 14 дней, по динамике индекса Лекена (ИЛ), выраженности боли по визуально–аналоговой шкале (ВАШ) и общей оценке эффективности лечения по мнению врача и больного. Также в ходе исследования оценивалась динамика АД на фоне лечения Кетоналом и Ортофеном.
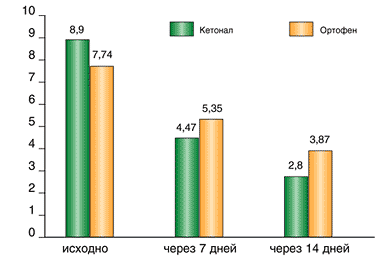
В I группе на момент начала терапии Кетоналом ИЛ составил 8,9±3,49, выраженность боли по ВАШ – 61,0±12,9; через неделю ИЛ – 4,47±2,4 (р=0,0012), ВАШ – 38,47±11,5 (р=0,0003); через 14 дней показатели составили 2,8±1,42 (р=0,0055) и 24,3±11,7 (р=0,013) соответственно (рис. 1,2). Эффективность Кетонала оценена 22 пациентами (73,3%) как очень хорошая, 7 (23,3%) как хорошая и лишь в 1 (3,4%) случае – как удовлетворительная. По мнению врача в 15 случаях (50%) отмечена очень хорошая эффективность препарата, в 12 случаях (40%) – хорошая эффективность и в 3 (10%) – удовлетворительная (табл. 1).
Рис. 1. Динамика индекса Лекена на фоне терапии Кетоналом и Ортофеном
Рис. 2. Динамика выраженности боли по ВАШ на фоне терапии Кетоналом и Ортофеном
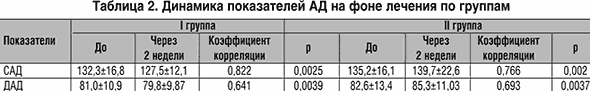
Отдельно оценивалось влияние используемых НПВП на уровень АД. В I группе среди нормотензивных пациентов под влиянием Кетонала зарегистрировано повышение АД лишь в одном случае. 13 пациентов I группы страдали сопутствующей ГБ, по поводу которой получали ингибиторы АПФ в 6 случаях, ингибитор АПФ и диуретик – 6 и дигидропиридиновый антагонист Са в 1 случае. Динамика уровня АД на фоне терапии НПВП отражена в таблице 2. Использование с противовоспалительной целью Кетонала у пациентов с сопутствующей ГБ потребовало усиления гипотензивной терапии только у 1 больного (7,7%).
Переносимость Кетонала оценили как хорошую 80% пациентов и врачей, как удовлетворительную – 16,7%, в 1 случае (3,3%) переносимость препарата признана неудовлетворительной как по мнению врача, так и больного. Из побочных эффектов 3 пациента (10%) отметили тошноту, 2 (6,7%) – гастралгии и 1 (3,3%) – изжогу; при фиброгастроскопии (ФГДС) у этих больных не выявлено поражения слизистой оболочки желудка. Симптоматические побочные эффекты не потребовали отмены препарата ни в одном случае.
Во II группе на момент начала лечения ИЛ составил 7,74±3,66, выраженность боли по ВАШ – 56,19±11,2; через 7 дней терапии Ортофеном ИЛ составил 5,35±3,39 (р=0,017), ВАШ – 44,97±11,56 (р=0,007); через 14 дней – 3,87±2,3 (р=0,08) и 37,39±12,34 (р=0,0085) соответственно (рис.1,2). При этом оценка эффективности лечения отличалась от I группы и по мнению врача, и по мнению больного. Только 1 пациент (3,2%) оценил эффект Ортофена как очень хороший, 11 пациентов (35,5%) оценили эффект как хороший, 11 (35,5%) – как удовлетворительный и 8 (25,8%) – как неудовлетворительный. По мнению врача очень хорошая эффективность Ортофена отмечена также в 1 случае (3,2%), в 11 случаях (35,5%) отмечалась хорошая эффективность, удовлетворительная – в 14 (45,2%) и неудовлетворительная – в 5 (16,1%) случаях (табл. 1).
Переносимость Ортофена оценили как хорошую только 38,7% пациентов и врачей, большая часть – 45,2% признали переносимость препарата удовлетворительной, в 5 случаях (16,1%) переносимость признана неудовлетворительной как по мнению врача, так и больного; т.е. переносимость Ортофена оказалась хуже, чем в группе Кетонала. Симптоматические побочные эффекты отмечены у 10 пациентов (32,3%), при этом у 6 больных (19,4%) препарат был отменен через две недели от начала лечения в связи с выявленным при ФГДС эрозивным поражением слизистой оболочки антрального отдела желудка. Среди побочных эффектов отмечались: изжога – у 8 (25,8%), гастралгии – у 4 (12,9%) и тошнота – у 2 (6,5%) больных.
Таким образом, проведенное открытое клиническое исследование позволяет говорить о том, что применение Кетонала при ОА характеризуется более выраженным анальгетическим действием и лучшей переносимостью, чем использование Ортофена. Терапия Кетоналом сопровождалась меньшим числом симптоматических побочных эффектов в сравнении с Ортофеном. При выборе НПВП для лечения ОА у больного, страдающего ГБ, особенно пожилого возраста, следует отдавать предпочтение именно Кетоналу, т.к. препарат обладает коротким периодом полураспада, характеризуется меньшим влиянием на уровень АД и проводимую гипотензивную терапию, чем другие «классические» НПВП.
1. Насонов Е.Л. Применение нестероидных противовоспалительных препаратов и ингибиторов циклооксигеназы–2 в начале XXI века. РМЖ, 2003, 11(7), 375–378.
2. Насонов Е.Л. Специфические ингибиторы ЦОГ 2: решенные и нерешенные проблемы. Клин. фармакол. и терапия, 2000, 1, 57–64.
3. Насонов Е.Л., Чичасова Н.В., Шмидт Е.И. Перспективы применения неселективных нестероидных противовоспалительных препаратов (на примере кетопрофена) и селективных ингибиторов ЦОГ–2 в клинической практике. РМЖ, 2002, 10(22), 1014–1017.
4. Чичасова Н.В., Имаметдинова Г.Р., Иголкина Е.В., Насонов Е.Л. Кетонал (кетопрофен) в практике ревматолога и терапевта. РМЖ, 2003, 11(23), 1288–1290.
5. Чичасова Н.В., Насонов Е.Л., Имаметдинова Г.Р. Применение кетопрофена (кетонал) в медицинской практике. Фарматека, 2003, 5, 30–32.
6. Gurwitz J.H., Avorn J., Bohn R.L. et al. Initiation of antihypertensive treatment during nonsteroidal anti inflammatory drug therapy. JAMA, 1994, 272, 781–786.
7. Jonson A.G., Nguyen T.V., Day R.O. Do nonsteroidal anti inflammatory drugs affect blood pressure? A meta analysis. Ann. Intern. Med., 1994, 121, 289–300.
8. Wolfe F, Anderson J, Burke TA, Arguelles LM, Pettitt D. Gastroprotective therapy and risk of gastrointestinal ulcers: risk reduction by COX 2 therapy. J. Rheumatol., 2002, 29, 467–473.
Послеоперационное обезболивание. Часть 4. Современные средства обеспечения послеоперационной анальгезии
Основными задачами применения анальгетических средств в послеоперационном периоде являются: устранение страдания, причиняемого болью, создание психологического комфорта и повышение качества жизни пациентов в послеоперационном периоде; ускорение послеоперационной функциональной реабилитации; снижение частоты послеоперационных осложнений; сокращение сроков госпитализации и стоимости лечения.
Нужно отметить, что в настоящее время в большинстве развитых стран неадекватное послеоперационное обезболивание рассматривается как нарушение прав человека и осуществляется в соответствии с принятыми национальными и международными стандартами. В нашей стране во многих клиниках внедрена формулярная система использования лечебных препаратов тех или иных групп, целесообразность применения которых подтверждена данными доказательной медицины, а также обусловлена потребностями и особенностями конкретного лечебного учреждения. Многие авторы полагают, что все хирургические подразделения, а также отделения анестезиологии, реанимации и интенсивной терапии должны иметь в своем арсенале только те анальгетики и анестетики, эффективность и безопасность назначения которых подтверждена доказательствами I (систематизированные обзоры и метаанализы) и II (рандомизированные контролируемые исследования с определенными результатами) уровня (табл. 1).
Таблица 1. Препараты, применение которых для послеоперационного обезболивания обосновано данными доказательной медицины (Acute Pain Management: Scientific Evidence, 2-nd edition, 2005).
Группа
Препараты
Дозы, путь введения
Неопиоидные анальгетики, НПВП
Диклофенак
Кетопрофен (Кетонал ®)
Кеторолак (Кеторол ®)
75 мг (150 мг суточная), в/м
50 мг (200 мг), в/м
30 мг (90 мг), в/м
Неопиоидные анальгетики, прочие
1 г (4 г), в/в инфузия в течение 15 минут
Опиоидные анальгетики, сильные
5-10 мг (50 мг), в/в, в/м
20 мг (160 мг), в/в, в/м
Опиоидные анальгетики, слабые
100 мг (400 мг), в/в, в/м
Лидокаин 2%
Бупивакаин (Маркаин®) 0, 25%, 0, 5%
Ропивакаин (Наропин®0, 2%, 0, 75%, 1%
(800 мг суточная) *
(400 мг суточная) *
(670 мг суточная) *
*инфильтрация краев раны, интраплевральное введение, продленная блокада периферических нервов и сплетений, продленная эпидуральная анальгезия.
Мировой опыт послеоперационного обезболивания позволяет выделить следующие основные современные тенденции в борьбе с ПБС:
— широкое применение неопиоидных анальгетиков – нестероидных противовоспалительных препаратов (НПВП) и парацетамола; в различных европейских клиниках частота назначения данных препаратов в качестве базиса послеоперационного обезболивания составляет от 45 до 99%;
— ограничение использования опиоидных анальгетиков, особенно внутримышечного варианта их введения, что обусловлено низкой эффективностью и значительным количеством побочных эффектов данной методики;
— мультимодальный характер послеоперационного обезболивания, т. е. одновременное назначение нескольких препаратов или методов обезболивания, способных воздействовать на различные механизмы формирования болевого синдрома.
Длительность проведения послеоперационного обезболивания является достаточно вариабельной величиной и зависит как от интенсивности болевой афферентации и, следовательно, от травматичности хирургического вмешателсьтва, так и от индивидуальной толерантности пациента к боли. Необходимость целенаправленного купирования ПБС возникает, как правило, в течение первых 4 суток послеоперационного периода (табл. 2).
Таблица 2. Потребность в обезболивании после различных по объему операций.
Хирургическое вмешательство
Продолжительность обезболивания, часы
Вмешательства на верхнем этаже брюшной полости и диафрагме
Вмешательства на нижнем этаже брюшной полости
Операции на тазобедренном суставе
Операции на конечностях
Лапароскопические операции среднего объема
Таблица 3. Методы и средства послеоперационного обезболивания.
1. Традиционное введение опиоидов: внутримышечные инъекции по требованию.
2. Опиоидные препараты агонисты/антагонисты:
а) парентеральное введение опиоидов: внутривенно болюсно, длительная внутривенная инфузия, контролируемая пациентом анальгезия.
б) непарентеральное введение опиоидов: щечное/подъязычное, пероральное, трансдермальное, назальное, ингаляционное, внутрисуставное
3. Неопиоидные анальгетики с системным введением:
а) нестероидные противоспалительные препараты
б) ацетаминофен (парацетамол)
4. Методы регионарной анестезии:
а) эпидуральное введение опиоидов;
б) нестероидные противовоспалительные препараты;
5. Нефармакологические методы:
6. Сочетанное использование представленных методов
Ниже приводятся основные используемые в современной хирургической клинике средства и методы обезболивания с позиций баланса их эффективности и безопасности.
Опиоидные анальгетики.
Данная группа лекарственных препаратов десятилетиями считалась средством выбора для купирования ПБС. Однако в настоящее время опиоидные анальгетики отнюдь не являются «золотым стандартом» в лечени пациентов с острой болью. Тем не менее, по оценкам целого ряда отечественных и зарубежных специалистов, эффективность обезболивания при традиционном назначении опиоидов в качестве монотерапии не превышает 25-30%. Однако постепенное отчуждение от чрезмерной приверженности опиоидам в послеоперационном периоде связана не столько с их недостаточной эффективностью, сколько с целым рядом серьезных побочных эффектов, возникающих при их использовании (табл. 4).
С точки зрения фармакодинамики опиоидные анальгетики являются агонистами или антагонистами различных видов опиоидных рецепторов ЦНС (мю-, дельта-, каппа-). Препараты опиоидной группы активируют эндогенную антиноцицептивную систему (центральная анальгезия), однако не влияют на периферические и сегментарные неопиоидные механизмы ноцицепции и не предотвращают центральную сенситизацию и гиперальгезию. Попытки увеличения эффективности обезболивания и снижения частоты побочных эффектов опиоидных анальгетиков основаны на варьировании способов их введения (в том числе и у одного пациента): внутривенный, внутримышечный, эпидуральный, трансдермальный, сублингвальный, ректальный. Наиболее распространенным, но при этом наиболее небезопасным и наименее эффективным способом введения опиоидов является внутримышечная инъекция. Данная методика наиболее часто приводит к неадекватному обезболиванию – более 60% пациентов отмечают неудовлетворительное качество послеоперационной анальгезии. Причины этого кроются в том, что всем пациентам вводятся фиксированные дозы через стандартные временные интервалы, без учета индивидуальной вариабельности фармакокинетики; часто инъекции опиоидов производятся с большими перерывами, то есть тогда, когда болевой синдром уже выражен и его купирование по определению становится малоэффективным. Именно при внутримышечном введении опиоидов наиболее часто развивается депрессия дыхания, связанная, возможно, с кумуляцией препарата.
Таблица 4. Опиоидные анальгетики при купировании послеоперационного болевого синдрома.
Препарат
Дозировка и пути введения
Относительная анальгетическая активность
Побочные эффекты
Возможны выраженные угнетение дыхания, тошнота, рвота, высокая степень привыкания и максимальный наркогенный потенциал
Угнетение дыхания, тошнота, рвота, высокая степень привыкания и наркогенный потенциал
Угнетение дыхания, тошнота, рвота, наличие привыкания и наркогенного потенциала
Необходимо отметить еще один важный аспект, ограничивающий применение опиоидных анальгетиков в отечественной клинической практике. Использование опиоидных анальгетиков для послеоперационного обезболивания в Российской Федерации строго регламентировано существующими приказами руководящих органов здравоозранения. Например, приказом № 257 Департамента здравоохранения г. Москвы от 2004 г. определяется, в частности, норматив потребления опиоидных препаратов в ампулах на 1 койку различных отделений хирургического профиля в год. Назначение опиоидного препарата как в хирургическом отделении, так и в отделении интенсивной терапии в большинстве ЛПУ сопровождается колоссальным количеством формальных сложностей, что нередко приводит к отказу медперсонала от использования ланных препаратов даже при необходимости назначения опиоидов. По тем же причинам самый современный метод применения опиоидов – контролируемая пациентом аналгезия, в наибольшей степени ориентированная на индивидуальные потребности пациента в обезболивании – в России не получила широкого распространения.
Неопиоидные анальгетики.
Термином «неопиоидные анальгетики» обозначается группа различных по химическому строению, фармакодинамике и, соответственно, механизму обезболивания лекарственных препаратов, применяемых для купирования ПБС с парентеральным, реже пероральным путем введения. Препараты данной группы, используемые как в моноварианте, так и в качестве средства адъювантной терапии, обладают различными анальгетическим потенциалом и совокупностью побочных эффектов (табл. 5).
Таблица 5. Неопиоидные анальгетики для купирования послеоперационной боли.
Класс
Препараты
Особенности терапии
Побочные эффекты
Антагонисты NMDA-рецепторов
Применяется как адъювант при введении опиоидов.
Малые дозы кетамина характеризуются опиоидсберегающим эффектом, повышением качества обезболивания
При использовании в малых дозах – не выражены. Сохраняют побочные эффекты опиоидов.
Антиконвульсанты
Используется как адъювантный препарат в комплексной терапии острой послеоперационной боли. Снижает потребность как в опиоидных, так и внеопиоидных анальгетиках.
Головокружение, сонливость, периферические отеки.
Ингибиторы протеаз
Ингибирование синтеза медиаторов боли на этапе трансдукции, используются как средство адъювантной терапии ПБС
Нерушения в системе гемостаза (гипокоагуляция) – послеоперационные кровотечения.
Центральные α-адреномиметики
Воздействие на трансмиссию и модуляцию боли. Адъювант при опиоидной анальгезии.
Гипотензия, брадикардия, психические нарушения.
Бензодиазепины
Комбинированная терапия с применением феназепама и тизанидина снижает выраженность фантомных болей.
Сонливость, головокружение, психические расстройства
Из приведенных данных становится очевидным, что перечисленные в таблице неопиоидные анальгетики используются лишь как возможное дополнение к базисной терапии опиоидами, использование данных препаратов для купирования ПБС в моноварианте не практикуется.
Формально к группе неопиоидных анальгетиков относятся также нестероидные противовоспалительные препараты (НПВП) и ацетаминофен (парацетамол). Однако вследствие значительной востребованности в современной хирургической клинике данные препараты рассматриваются сейчас как отдельные подклассы средств для купирования ПБС.
Парацетамол.
Несмотря на то, что ацетаминофен (парацетамол) имеет более чем полувековую историю применения в качестве анальгетика и антипиретика, точный механизм действия этого препарата до сих пор не известен. Предполагается наличие центрального механизма действия парацетамола, включающего: подавление активности циклооксигеназы 2 типа в ЦНС, с чем связана профилактика развития вторичной гиперальгезии; подавление активности циклооксигеназы 3 типа, существование которой предполагается и которая, видимо, обладает селективной чувствительностью к парацетамолу; усиление активности нисходящих тормозных серотонинергических путей на этапе модуляции боли.
Потенциально опасным побочным свойством парацетамола является гепатотоксическое и нефротоксическое действие, которое может проявляться при превышении дозы 4 г/сут, особенно при наличии у пациента исходного нарушения функции печени и почек. Ограничениями к применению парацетамола являются: печеночно-клеточная недостаточность с лабораторными проявлениями (повышение уровня трансаминаз), почечная недостаточность, алкоголизм, алиментарная недостаточность, дегидратация.
Местные анестетики.
Важнейшей задачей мультимодальной анальгезии является прерывание афферентного потока ноцицептивных стимулов от периферических болевых рецепторов в органах и тканях к сегментарным структурам ЦНС (задним рогам спинного мозга). Эта задача может быть успешно решена при помощи различных методов регионарной и местной анальгезии. Важную роль в расширении применения методов региональной анальгезии сыграло появление современных местных анестетиков (бупивокаин, ропивокаин), а также детальная отработка методики регионарных блокад.
Эпидуральная анальгезия занимает ключевую позицию среди всех регионарных методов послеоперационного обезболивания. В ходе данной процедуры в эпидуральное пространство на уровне грудного или поясничного отделов позвоночника устанавливается катетер, через который болюсно или путем непрерывной инфузии вводятся местные анестетики. Эпидуральная анестезия является как средством обеспечения анальгезии в ходе операции (в том числе и в моноварианте), так и средством купирования ПБС. Многочисленными исследованиями была доказана принципиально более высокая эффективность продленной послеоперационной эпидуральной анальгезии по сравнению с системным введением опиоидных анальгетиков. Как указывалось выше сами опиоидные анальгетики также могут быть использованы для проведения эпидуральной анестезии. Известно, что эпидуральное введение местных анестетиков и опиоидов достоверно превышает анальгетический эффект использования данных препаратов в отдельности. Тем не менее само по себе эпидуральное введение опиоидов чревато возникновением серьезных побочных эффектов от угнетения дыхания до выраженного кожного зуда. На сегодняшний день принято считать, что преимущества эпидурального введения опиоидных анальгетиков в абдоминальной хирургии не перевешивают риска осложнений самой методики эпидуральной анестезии по сравнению с парентеральным назначением аналогичных препаратов.
Помимо собственно анальгетического эффекта позитивное влияние прослеоперационной продленной эпидуральной анальгезии заключается в прерывании нисходящих симпатических эфферентных импульсов, следствием чего являются улучшение висцерального кровотока (активизация репаративных процессов в зоне вмешательства), повышение активности парасимпатической нервной системы (разрешение пареза пищеварительной трубки).
С точки зрения доказательной медицины (Acute Pain Management: Scientific Evidence, 2-nd edition, 2005) преимущества продленной эпидуралной анальгезии включают: более высокое качество обезболивания в сравнении с парентеральным введением опиоидов; улучшение показателей газообмена и снижение частоты послеоперационных легочных осложнений по сравнению с опиоидной анальгезией; ускорение восстановления функции желудочно-кишечного тракта после абдоминальных операций и снижение частоты местных осложнений.
Тем не менее и у эпидуральной анестезии есть ряд существенных ограничений. Сама по себе эпидуральная анестезия является сложной инвазивной процедурой, потенциально опасной в плане развития как местных (инфекционный процесс, повреждение нервных корешков, сосудов паутинной оболочки, твердой мозговой оболочки), так и системных осложнений (депрессия дыхания, кардиотоксические эффекты, артериальная гипотензия). В этой связи проведение эпидуральной анестезии требует наличия специальных навыков у врача-анестезиолога и постоянного мониторинга состояния пациента в отделении интенсивной терапии, реже – в хирургическом отделении.
В последние годы все большую популярность получает методика длительной инфузии местных анестетиков в полость операционной раны. В ходе ряда исследований было показано, что длительная инфузия местных анестетиков в течение 24-48 часов через катетер, установленный в ране, способна повысить качество обезболивания и снизить потребность в опиоидных анальгетиках. Работами отечественных авторов показано, что пролонгированная местная анестезия операционной раны за счет резорбции местного анестетика и присутствия его в плазме в низких концентрациях способна оказывать системный противовоспалительный эффект. Как и в случае эпидуральной анальгезии эффект местных анестетиков при этом обусловлен блокадой не только ноцицептивных путей, но и симпатической иннервации. Говоря о применении пролонгированной местной анестезии операционной раны, следует заметить, что данная методика в настоящее время находится на стадии клинической апробации и ее широкое внедрение изначально ограничивают очевидный риск экзогенного инфицирования раны и реальная опасность системных токсических эффектов местных анестетиков (артериальная гипотензия, аритмии, угнетение дыхания) вследствие их резорбции тканями.
Мультимодальная периоперационная анальгезия.
Из приведенных выше характеристик и, что важнее, недостатков средств и методов купирования ПБС следует очевидное заключение о том, что в настоящее время не существует идеального анальгетика или метода лечения острой послеоперационной боли. Однако приблизиться к решению проблемы адекватности послеоперационного обезболивания вполне возможно, реализуя в клинике концепцию мультимодальной периоперационной анальгезии, предусматривающей одновременное назначение двух и более анальгетиков и/или методов обезболивания, обладающих различными механизмами действия и позволяющих достичь адекватной анальгезии при минимизации побочных эффектов до, во время и после хирургического вмешательства (см. рис. ).
Таблица 6. Варианты схем мультимодальной периоперационной анальгезии, ориентированных на травматичность хирургических вмешательств.