что представляет собой модель атома предложенная томсоном
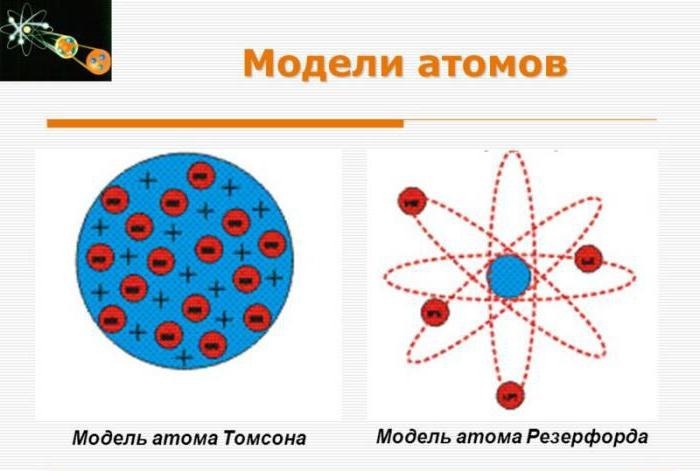
Модель атома Томсона
«Существование атомов невозможно доказать. Их нельзя увидеть, нельзя потрогать, они существуют только в нашем воображении. Это абстракция.»
Эрнст Мах
Со времен Демокрита атом считался элементарной структурной единицей вещества. А так ли это? Оказывается, нет. И первым, кто это доказал, был английский физик Джозеф Томсон.
Преддверие открытия
Плюккер поставил довольно простой эксперимент. В герметичную стеклянную трубку с разреженным газом были помещены два электрода. Катод подключался к отрицательному полюсу батареи, анод—к положительному. При подаче высокого напряжения газ в трубке начинал светиться. Откачивая газ из трубки, Плюккер наблюдал постепенное исчезновение свечения, и лишь слегка оно оставалось в области анода. Так в 1859 году было открыто новое излучение.
Немецкий физик Ойген Гольдштейн продолжил работу Плюккера, он высказал идею о волновой природе открытого излучения и назвал его катодными лучами. Англичанин Уильям Крукс не согласился с ним и предположил, что катодные лучи являются потоками частичек вещества. Его правоту уже 1895 году подтвердил французский физик Жан Перрен, который экспериментально доказал, что этот поток движется прямолинейно, но может отклоняться магнитным полем.
Можно сказать, что подготовительные работы к раскрытию тайны атома были уже проведены. В этом же году к исследованию катодных лучей в Кавендишской лаборатории Кембриджского университета приступает ее директор Джозеф Томсон. Изучая отклонение лучей в магнитном поле, он приходит к выводу, что все частицы, образующие катодные лучи, одинаковы, или, говоря языком физики, тождественны, и являются составляющими вещества. Измерив скорость их движения, которая была значительно ниже скорости света, Томсон понял, что они обладают массой и находятся в составе атомов. А значит, атом не такой уж и неделимый.
«Каша в голове — так поделись с ближним!» (Джозеф Джон Томсон)
Атом-пудинг. Как это по-английски!
После открытия электрона неделимость атома уже стала доказанным фактом, и пришла пора построить модель атома. К построению этой модели и приступил Джозеф Томсон. И лишь спустя семь лет, в 1904 году, он предложил один из ее вариантов.
Согласно его модели, атом состоит из отрицательно заряженных электронов (хотя сам Томсон называл их «корпускулами»), обладающих наименьшим квантованным зарядом — то есть не может быть заряда меньше, чем у электрона, и не может быть заряда в полтора электрона, — и положительно заряженного «шара» (или облака), компенсирующего отрицательные заряды электронов. Так что в целом атом электронейтрален.
Модель напоминала пудинг, в котором находились изюминки, впоследствии она получила название «пудинговая модель атома». Справедливости ради следует заметить, что сам ученый никогда не давал ей такое название.
В соответствии с этой моделью электроны могли свободно вращаться в капле или облаке такой положительно заряженной субстанции. Их орбиты стабилизировались тем, что при удалении электрона от центра положительно заряженного облака он испытывал увеличение силы притяжения, возвращающей его обратно, поскольку внутри его орбиты было больше вещества противоположного заряда, чем снаружи. В модели Томсона электроны могли свободно вращаться по кольцам, которые стабилизировались взаимодействиями между электронами, а наличие спектров объясняло энергетические различия между различными кольцевыми орбитами.
Модель Томсона была способна объяснить излучение атомом электромагнитных волн определенной частоты колеблющимися электронами, выведенными из положения равновесия, но она не смогла объяснить излучение большого числа спектральных линий. Также модель Томсона не давала возможности понять, что определяет размеры атомов. Но это был только первый шаг в познании структуры атома. Поскольку выяснилось, что электрон обладает наименьшим квантованным зарядом, открытие Томсона еще раз доказало существование квантовой природы физических процессов в микромире.
Электрон как частица был обнаружен в 1897 году английским физиком Джозефом Джоном Томсоном. Через 9 лет ученому присудили Нобелевскую премию с формулировкой «за исследования проводимости электричества газами». Его сын, Джордж Паджет Томсон, в 1927 году обнаружил волновые свойства электрона и впоследствии тоже удостоился Нобелевки «за экспериментальное открытие дифракции электронов на кристаллах».
Вопросы.
1. Что представлял собой атом согласно модели, предложенной Томсоном?
Томсон предложил модель согласно которой атом представляет собой электрически нейтральный шар, внутри которого равномерно распределен положительный заряд и, находятся отрицательно заряженные электроны, совершавшие колебательные движения около положения равновесия.
2. Пользуясь рисунком 168. расскажите, как проводился опыт по рассеянию α-частиц.
3. Какой вывод был сделан Резерфордом на основании того. что некоторые α-частицы при взаимодействии с фольгой рассеялись на большие углы?
Резерфорд сделал вывод, что внутри атома имеется чрезвычайно сильное электрическое поле (которое и отталкивает α- частицы) и, что такое поле может быть создано зарядом, сконцентрированном в очень малом объеме.
4. Что представляет собой атом согласно ядерной модели. выдвинутой Резерфордом?
Согласно модели Резерфорда в центре атома находится положительно заряженное ядро, в котором сконцентрирована практически вся масса атома, вокруг которого движутся электроны.
5. По рисунку 169 расскажите, как проходят α-частицы сквозь атомы вещества согласно ядерной модели.
Модель атома Томсона
Модель Томсона (иначе называемая «пудинговая модель атома») — модель атома, предложенная в 1904 году Джозефом Джоном Томсоном. Открыв в 1897 году электрон, Томсон предположил, что «корпускулы»(так Томсон называл электроны, хотя ещё в 1894 году Дж. Дж. Стоуни предложил называть «атомы электричества» электронами [1] ) являются составными частями атома и решил создать модель атома, отражающую это предположение.
Содержание
Описание модели
С точки зрения Томсона:
…атомы элементов состоят из нескольких отрицательно заряженных корпускул, заключённых в сферу, имеющую однородно распределённый положительный электрический заряд… [2]
Атом по Томсону состоит из электронов, помещённых в положительно заряженный «суп», компенсирующий отрицательные заряды электронов, подобно отрицательно заряженным «изюминкам» в положительно заряженном «пудинге». Электроны, как предполагалось, были распределены по всему атому. Было несколько вариантов возможного расположения электронов внутри атома, в частности вращающиеся кольца электронов. В некоторых вариантах модели вместо «супа» предлагалось «облако» положительного заряда.
Согласно этой модели, электроны могли свободно вращаться в капле или облаке такой положительно заряженной субстанции. Их орбиты стабилизировались тем, что, при удалении электрона от центра положительно заряженного облака, он испытывал увеличение силы притяжения, возвращающей его обратно, поскольку внутри его орбиты было больше вещества противоположного заряда, чем снаружи (по закону Гаусса). В модели Томсона электроны могли свободно вращаться по кольцам, которые стабилизировались взаимодействиями между электронами, а спектры объясняли энергетические различия между различными кольцевыми орбитами.
Статья Томсона была опубликована в марте 1904 года в Философском журнале (Philosophical Magazine), ведущем британском научном журнале того времени. Томсон позднее пытался объяснить с помощью своей модели яркие спектральные линии некоторых элементов, но не особо в этом преуспел.
Тем не менее, модель Томсона (также как подобная модель сатурнианских колец для электронов атомов, которую выдвинул тоже в 1904 году Нагаока, по аналогии с моделью колец Сатурна Джеймса Клерка Максвелла) стала ранним предвестником более поздней и более успешной модели Бора, представляющей атом как подобие Солнечной системы.
Опровержение модели Томсона
Строение планетарной модели атома Томсона: плюсы и минусы
Модель атома Томпсона — что из себя представляет
Модель атома Томпсона является одной из ранних моделей, описывающей строение атома, которая в дальнейшем была признана несостоятельной.
Рассматриваемая модель атома была представлена в 1904 году Д.Д. Томпсоном. Открытию предшествовало обнаружение электронов, а после формулировки гипотезы было обнаружено атомное ядро.
Томпсон выдвинул предположение о том, что атом является равномерно распределенным по всему объему зарядом со знаком плюс. Положительно заряженное «облако» содержит внутри небольшие электроны с отрицательным зарядом, расположение которых определено случайно.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Подобная модель напоминает пудинг с изюмом. Общий заряд атома нейтрален, что обусловлено равенством по модулю суммарного заряда электронов и заряда «облака». Данную модель нередко называют «пудинговой моделью атома».
Предыстория открытия, чем отличалась от модели Резерфорда
В физике 1897 год отмечен знаменательным событием. В это время Джозефом Джоном Томпсоном были открыты электроны. Таким образом, ученому удалось экспериментальным путем подтвердить гипотезу о том, что атом – не «монолитная» частица. Вместе с тем отсутствовало точное представление о характере элементарных частиц.
В результате серии опытов был определен отрицательный заряд электронов. При этом имелась информация о нейтральном заряде атомов. Томпсон выдвинул предположение о наличии некого источника положительного заряда в атоме, что позволяет компенсировать отрицательный заряд электронов. Английским физиком было выдвинуто несколько вероятных механизмов взаимодействия частиц, находящихся внутри атома:
Ученый остановился на третьем варианте, который казался ему наиболее вероятным, отражающим структуру атомов. Публикация модели атома Томпсона состоялась в 1904 году в мартовском выпуске издания Philosophical Magazine. Журнал пользовался авторитетом в Британии.
Мнение автора заключалось в том, что атомы элементов включают в себя определенное количество отрицательно наэлектризованных корпускул или электронов, которые заключены в сферу равномерной положительной электризации. Тем самым, ученый отказался от предшествующей своей теории о «туманном атоме», согласно которой частицы состояли из нематериальных вихрей.
Научное сообщество проявило большой интерес к публикации Томпсона. Однако гипотеза столкнулась с критикой со стороны многих авторитетных физиков по причине отсутствия прочных доказательств. С другой стороны, рассматриваемая модель атома полностью отвечала представлениям и результатам экспериментов, которые были известны в то время.
Только в 1911 году была представлена более точная модель атома Резерфорда. Отличие от модели Томпсона заключается в том, что, согласно представлениям Резерфорда, положительный заряд расположен в малой области атома, а компенсирующие электроны окружают его. К такому утверждению ученый пришел в результате экспериментов по бомбардировке атомов. В дальнейшем данная модель рассматривалась в качестве планетарной модели атома по Резерфорду.
Как описывал атом Томпсон, почему модель назвали «Пудинг с изюмом»
Томпсон был известен, как проницательный и практичный ученый. Основываясь на известных экспериментальных данных, он выдвинул гипотезу об атомной модели. Предположение о том, что объем заряда положительный, является отражением научного подхода Томпсона к открытию, которое стало руководством к действию для дальнейших экспериментов.
Исходя из теории, стабилизация орбит электронов внутри атомной модели Томпсона объясняется воздействием возрастающей силы притяжения на электрон, удаляющийся от центра положительно заряженной сферы или облака. Данное воздействие способствует возвращению электрона, что обусловлено законом Гаусса, подтверждающим более высокую концентрацию положительного заряда во внутренней области сферы.
Рассматриваемая модель предполагает свободное вращение электронов по кольцам, дополнительно стабилизированным, благодаря взаимодействию электронов между собой. С помощью спектроскопических значений объяснялись энергетические различия между отдельными кольцевыми орбитами.
По представлениям тех времен, расположение электронов в сфере с положительным зарядом напоминало изюм в пироге или фруктовые кусочки в сливовом пудинге. В связи с этим концепция приобрела название «пудинговой» модели атома.
Плюсы и минусы теории
Модель Томпсона является объяснением излучения атомов. Однако весь комплекс эмпирических данных по спектрам атома не был подтвержден в этой модели. Формулы определенных химических элементов описали их спектры, но противоречили рассматриваемой модели. Таким образом, с помощью модели Томпсона не получилось объяснить дискретный характер, которым обладают спектры атомов.
Проблема также заключалась в описании устойчивости атома. Представленная модель не могла охарактеризовать рентгеновское и гамма-излучения, которые испускают атомы. Кроме того, отсутствовали пояснения относительно определения размеров атома. Модель противоречила опытам, направленных на изучение того, как распределяется положительный заряд в атоме. Спустя некоторое время после создания модель Томсона признали ошибочной.
В настоящее время рассматриваемая модель имеет историческое значение и, несмотря на несостоятельность, является важным элементом в цепочке развития научных знаний о строении вещества. В качестве еще одного достоинства модели атома Томпсона можно отметить ее простоту. Благодаря этому преимуществу, гипотезу удалось опровергнуть и продвигать науку дальше.
Дилемма несоответствия, дальнейшее развитие
С увеличением объема экспериментальных данных научное сообщество убеждалось в том, что сущность модели атома Томпсона не соответствовала действительности. Попытки ученого усовершенствовать выдвинутую гипотезу не увенчались успехом. Томпсону не удалось объяснить некоторые из ключевых спектральных линий, которые были выявлены опытным путем при исследовании состава нескольких элементов.
В 1909 году Ганс Гейгер и Эрнест Марсден под кураторством профессора Эрнеста Резерфорда поставили опыты над тонким золотым листом. Схема эксперимента заключалась в рассеивании альфа-частиц на фольге из золота. Полученные данные не оправдали ожидания. В 1911 году Резерфорд по итогу длительных размышлений представил миру собственную концепцию, которая затем получила название «модель атома Резерфорда».
Ученый предположил, что в центральной области атомов золота находится очень маленькое ядро, обладающее мощным положительным зарядом, что позволяет удержать порядка ста электронов.
Сразу после публикации гипотезы Резерфорда было выдвинуто предположение ученым Антониусом Ван ден Бруком о равенстве атомного номера элемента общему количеству единиц заряда, которые присутствуют в его ядре. В 1913 году Генри Мозли предоставил нужную информацию, доказывающую теорию Ван ден Брука. Было установлено соответствие эффективного ядерного заряда атомному номеру.
Исследование легло в основу характеристики полуклассической модели атомов, созданной Нильсом Бором в 1913 году. Данная модель напоминает то, как взаимодействуют Солнце и планеты в Солнечной системе, но при наличии квантовых ограничений.
Хаас опубликовал работу на три года раньше, чем были представлены выводы Нильса Бора. Важно заметить, что боровская модель обеспечивает достаточно точные прогнозы для атомных и ионных систем, имеющих один эффективный электрон. С помощью теории «пудинга» можно рассчитать оптимальное распределение идентичных точечных зарядов на единичной сфере, которую называют проблемой Томпсона.
Электростатическое взаимодействие электронов, которые ограничены с помощью сферических квантовых точек, идентично их обработке в атомной модели Томпсона. Классическая задача подразумевает моделирование квантовой точки как простой диэлектрической сферы со свободными или избыточными электронами, а не однородной сферы с положительным зарядом, которая описана в модели «пучкового пудинга».
Строение атома
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: планетарная модель атома.
Атомы каждого химического элемента имеют строго индивидуальный линейчатый спектр, присущий только данному элементу и не меняющийся от опыта к опыту. Как это можно объяснить? Как вывести формулу, дающую весь набор частот атомного спектра? Чтобы сделать это, нужно узнать, как устроен атом.
Модель Томсона
Первую модель строения атома придумал английский физик Джозеф Джон Томсон (удостоенный Нобелевской премии за открытие электрона). В конечном счёте она оказалась неверной, но сыграла важную роль, будучи стимулом последующих экспериментальных исследований Резерфорда. Физики называли модель Томсона «пудинг с изюмом».
Согласно Томсону атом представляет собой шар размером порядка см. По этому шару некоторым образом распределён положительный заряд, а внутри шара, подобно изюминкам, находятся электроны (рис. 1 ).
Рис. 1. Модель атома Томсона
Суммарный заряд электронов в точности равен положительному заряду шара, поэтому атом в целом электрически нейтрален.
Излучение атомов объясняется колебаниями электронов около положений равновесия (как вы помните, любой ускоренно движущийся заряд излучает электромагнитные волны). Однако вся совокупность экспериментальных данных по атомным спектрам не укладывалась в модель Томсона. Например, для некоторых химических элементов были подобраны формулы, хорошо описывающие их спектры, но эти формулы из модели Томсона никак не следовали.
Опыты Резерфорда
Но в те времена об атомных ядрах ещё ничего не знали — о них Резерфорду лишь предстояло догадаться, глядя на результаты своих знаменитых опытов!
Планетарная модель атома
Эта величина на пять порядков (в сто тысяч раз!) меньше размера атома. Так на смену модели Томсона пришла планетарная модель атома (рис. 3 ).
Рис. 3. Планетарная модель атома
В центре атома находится крошечное положительно заряженное ядро, вокруг которого, словно планеты вокруг Солнца, движутся электроны. Между ядром и электронами действуют силы кулоновского притяжения, но упасть на ядро электроны не могут за счёт своего движения — точно так же, как и планеты не падают на Солнце, хоть и притягиваются к нему.
Заряд ядра по модулю равен суммарному заряду электронов, так что атом в целом электрически нейтрален. Однако электроны могут быть выбиты из своих орбит и покинуть атом — тогда атом превращается в положительно заряженный ион.
Масса электронов составляет очень малую часть общей массы атома. Например, в атоме водорода всего один электрон, и его масса в раз меньше массы ядра. Следовательно, почти вся масса атома сосредоточена в ядре — и это при том, что ядро в сто тысяч раз меньше самого атома.
Чтобы лучше почувствовать соотношение масштабов атома и ядра, представьте себе, что атом стал размером с Останкинскую телебашню ( м). Тогда ядро окажется горошиной размером мм, лежащей у вас на ладони. И тем не менее, почти вся масса атома заключена в этой горошине!