что препятствует свертыванию крови
Препараты для разжижения крови
Согласно результатам медицинских исследований, у сердечно-сосудистых заболеваний могут быть разные причины. И если одни (наследственность, возраст) остаются неизменными, то другие можно корректировать с помощью отказа от вредных привычек и изменения образа жизни.
Повышенная вязкость крови – медицинский термин, эквивалентный разговорному выражению «густая кровь». Традиционно считается, что сгущение крови связано с повышением уровня протромбина – компонента свертывающей системы крови. Такое мнение бытует из-за того, что такие серьезные осложнения сердечно-сосудистых заболеваний, как инфаркт и инсульт, чаще возникают при повышенном уровне протромбина. На самом деле вязкость определяется многими факторами.
Главная функция крови заключается в транспортировке дыхательных газов, гормонов, питательных и многих других веществ к органам и системам. От этого напрямую зависят практически все активные процессы, которые происходят в нашем организме. Отклонение от нормы провоцирует её сгущение и разжижение. И в первом, и во втором случаях это приводит к нежелательным результатам.
Как определить у себя сгущение крови?
Для хорошего движения по сосудам кровь должна быть достаточно текучей. Гемостаз — биологическая система, которая, с одной стороны, сохраняет жидкое и текучее состояние крови, а с другой стороны, останавливает кровотечения путем свертывания крови (коагуляции). Коагулограмма – лабораторный тест, который как раз и оценивает, насколько эффективно работает гемостаз.
Риск повышенного тромбообразования имеют люди с ожирением, сахарным диабетом, нарушениями ритма сердца (среди которых наиболее значимы фибрилляция и трепетание предсердий), низкой двигательной активностью, пациенты после крупных операций (например, протезирования суставов, клапанов сердца, экстренных операций и т. п.), с варикозной болезнью, перенесенными инфарктами миокарда, инсультами, с различными аутоиммунными заболеваниями.
Тромбообразование в определенном участке сосудистого русла сопровождается острым или постепенным нарушением кровоснабжения какого-либо органа с нарушением его функций и последующим некрозом тканей.
Помимо вышеперечисленных состояний, коагулограмму выполняют перед операциями для оценки риска кровотечений, при назначении некоторых лекарственных препаратов, а также обязательно при заболеваниях печени, поскольку большая часть белков системы свертывания крови синтезируется именно в этом органе.
Как действуют препараты для разжижения крови?
Так называемые разжижители помогают крови плавно течь по венам и артериям. Они используются для лечения сердечных заболеваний, препятствуют образованию опасных сгустков в сосудах.
При этом многие заблуждаются, думая, что препараты реально делают кровь более жидкой и каким-то чудом разбивают тромбы. Нет, это не так, но они не дают крови образовывать новые сгустки, а также замедляют рост уже существующих тромбов.
Классификация препаратов
В современной медицинской практике существует две группы противосвертывающих препаратов для разжижения крови на длительный прием, и для каждой есть свои конкретные показания.
1) Кардиологические аспирины (аспирин кардио, кардиомагнил, аспекард, полокард и т.д.). Показаны всем, у кого обнаружены или подозреваются атеросклеротические бляшки – ведь аспирин предотвращает “растрескивание” и тромбирование бляшек (процессы, которые приводят к инфаркту или инсульту).
2) Непрямые антикоагулянты – варфарин и его более дорогие сородичи (прадакса, ксарелто и др.). Предотвращают образование тромбов в местах, где ток крови по разным причинам замедляется и вследствие этого есть опасность образования тромбов.
Лекарства, разжижающие кровь, можно принимать:
Оральные антикоагулянты, вмешиваясь в этот процесс, существенно увеличивают время свертывания крови. Однако пероральные антикоагулянты не разжижают кровь и не растворяют уже образовавшиеся сгустки крови, хотя и позволяют прекратить рост имеющихся тромбов.
В норме естественные антикоагулянты крови способствуют тому, что ее свертывание происходит только при нарушении целостности кровеносных сосудов. Однако при определенных клинических состояниях, называемых тромбозными нарушениями, этот же механизм может приводить к нежелательному образованию опасных для жизни кровяных сгустков — тромбов. В таких ситуациях действие антикоагулянтов позволяет предотвратить избыточное тромбообразование.
Кровотечение должно быть остановлено
Кровь как орган
Форменные элементы крови
Рисунок 1. Форменные элементы крови
Тромбоциты (кровяные пластинки) представляют собой фрагменты гигантских клеток костного мозга. Совместно с белками плазмы они обеспечивают быстрое свертывание крови, вытекающей из поврежденного кровеносного сосуда, что приводит к остановке кровотечения и тем самым защищает организм от кровопотери.
Баланс свертывающей и противосвертывающей систем крови
Факторы, нарушающие это хрупкое равновесие, например, даже незначительные повреждения стенки кровеносного сосуда приводят к ускорению времени свертывания крови и образованию более крупных сгустков крови, видимых невооруженным глазом. Поэтому неудивительно, что и искусственный клапан сердца также может нарушить естественный баланс свертывающей и противосвертывающей систем.
Для измерения свертываемости крови необходим простой анализ на определение времени свертывания крови, позволяющий рассчитать международное нормализованное отношение (МНО) при помощи автоматического анализатора свертывания крови.
Чем ниже МНО, тем быстрее сворачивается кровь, то есть тем она «гуще». Чем выше МНО, тем дольше сворачивается кровь, то есть тем она «жиже» и выше опасность кровотечений.
Анализ на свертывание крови позволит подобрать наиболее оптимальную дозировку антикоагулянтов.
Нарушения свертываемости крови
Поделиться:
Некоторые люди ужасно боятся вида порезанного пальца, особенно собственного, — однако страх этот иррационален. Здоровый человек попросту не может истечь кровью через даже довольно крупные порезы, поскольку природа снабдила нас отличным механизмом свертывания крови. Но как понять, что свертывание ухудшилось?
Кто сворачивает кровь
Система гемостаза (остановки кровотечения) состоит из двух звеньев — сосудисто-тромбоцитарного и коагуляционного, он же плазменный.
Сосудисто-тромбоцитарное звено действует следующим образом: в момент ранения поврежденные клетки стенки сосуда выбрасывают ряд специальных веществ, которые активируют тромбоциты. В результате тромбоциты спутываются между собой, образуя рыхлую массу, и обретают способность к адгезии (прилипание к поврежденному месту сосуда) и агрегации (слипание в кучки). Так образуется первичный рыхлый тромб. Для капиллярного кровотечения (порезанный палец) его достаточно, но в крупных сосудах, где кровь движется с высокой скоростью, такую конструкцию просто «выбьет» напором.
Поэтому необходимо коагуляционное звено — это и есть собственно свертывание. Факторы свертывания (ФС) присутствуют в плазме крови постоянно, причем в таком количестве, что хватило бы практически на всю кровь разом (напрашивается сюжет для фильма ужасов). Но, как и тромбоциты, ФС находятся в неактивном состоянии, пока раненая сосудистая стенка не издаст свой биохимический «крик о помощи». После активации факторы свертывания образуют трехмерную сеть из фибрина, задача которой — укутать первичный тромб, укрепив его и крепко зафиксировав на поврежденном участке.
Нарушения в работе первого звена
Поскольку первое звено имеет два компонента, то и проблемы могут возникнуть с любым из них. Понижение свертываемости тромбоцитарного происхождения может иметь две причины: снижение числа тромбоцитов или их генетическая неполноценность. К кровоточивости приводит и повышенная ломкость сосудистой стенки (тоже, как правило, генетически обусловленная).
Любой из этих вариантов даст о себе знать легко возникающими синяками, которые берутся «неизвестно откуда», т. е. при таких легких ударах, которые человек даже не запоминает; также характерны частые носовые, десневые, у женщин — маточные кровотечения.
Читайте также:
Носовое кровотечение
Пробы, которые проводит врач при подозрении на поражение первого звена, настолько несложные, что часть из них можно выполнить самостоятельно. Например, щипковая проба: кожу под ключицей собирают в складку и делают щипок. Результат пробы оценивают через 24 часа — у здорового человека никаких видимых следов не останется.
Достаточно просты и лабораторные методы: это изучение количества тромбоцитов (составная часть общего анализа крови) и их формы, оценка времени кровотечения и вычисление индекса ретракции кровяного сгустка.
Нарушения в работе второго звена
Проблемы второго звена — это так называемые коагулопатии, т. е. генетическое отсутствие или недостаточная активность того или иного фактора свертывания. Коагуляционный каскад устроен как советская елочная гирлянда: если «ломается» какой-то один фактор, то «не горит» вся гирлянда, т. е. нарушается весь процесс.
Самым известным примером являются оба вида гемофилии — отсутствие в крови больного человека VIII или IX фактора. Как правило, это диагностируется еще в детстве, потому что очень сложно пропустить образование крупных гематом, беспричинное появление крови в моче, неостанавливающиеся кровотечения при травмах.
Для подтверждения диагноза используются тесты на время свертывания, тромбиновое время, активированное частичное тромбопластиновое время и прицельное исследование уровня того или иного ФС.
Нарушение коагуляции из-за лекарств
В отдельную группу стоит выделить пациентов, получающих пожизненную антикоагуляционную терапию — как правило, это варфарин. Список показаний для такого лечения очень широк — это различные тромбозы, профилактика осложнений после инфаркта миокарда, постоянная форма фибрилляции предсердий, протезированные клапаны сердца и многое другое.
Но с уменьшением способности крови к свертыванию увеличивается риск кровотечений. Именно поэтому жесткое условие успешного лечения антикоагулянтами — это регулярный контроль международного нормализованного отношения (МНО) крови. Это показатель одновременно и эффективности, и безопасности лечения. Если снизить свертываемость крови недостаточно — не будет эффекта; если перестараться — велик риск серьезных осложнений.
Контроль МНО должен проводиться как минимум раз в месяц. Сегодня существуют приборы для самостоятельного измерения МНО — они очень просты в обращении и позволяют гораздо лучше отслеживать свое состояние. На эффект варфарина влияют и другие лекарства, принимаемые одновременно с ним, и даже изменения в диете. Вы можете забыть упомянуть о них при посещении своего врача, но прибор поможет избежать последствий.
Так что если вас смущают синяки или частая кровь на зубной щетке — не стесняйтесь, расскажите об этом своему терапевту. А если вы точно знаете, что в вашу систему свертывания уже вмешались с помощью лекарств, то вам абсолютно необходимы регулярные проверки.
Для чего нужны оральные антикоагулянты?
Антикоагулянты — это лекарственные препараты, снижающие активность свертывающей системы крови и препятствующие чрезмерному образованию тромбов. Современные антикоагулянты оказывают влияние на различные звенья процесса коагуляции крови и применяются для профилактики и лечения артериальных или венозных тромбозов и тромбоэмболий.
Классификация антикоагулянтов
Все антикоагулянтные препараты разделяются на две большие группы:
Антикоагулянты непрямого действия
Витамин К — витамин естественного происхождения, содержащийся в основном в зеленых листовых овощах (шпинат, брокколи, латук) и попадающий в организм с пищей. Кроме того, витамин K синтезируется бактериями в кишечнике. Организм использует витамин К для образования в печени целого ряда белков, участвующих в свертывании крови. Суточная потребность витамина К: 0,03-1,5 мкг/кг/сут (до 105 мкг/сут).
Таблица 1. Содержание витамина К в продуктах (мкг/100 г продукта)
| Продукты | Содержание витамина К |
| Зеленый чай, листья | 964 |
| Салат-латук, зеленые листья | 850 |
| Мангольд, листья сырые | 830 |
| Капусты лист | 817 |
| Кочанная капуста, сырая | 487 |
| Брюссельская капуста | 434 |
| Шпинат, листья сырые | 383 |
| Шпинат, листья свежие/замороженные, сваренные | 360 |
| Черный чай, листья | 42 |
| Брюссельская капуста, свежая, замороженная | 289 |
| Цикорий сырой | 231 |
| Салат краснолистный | 210 |
| Брокколи сырая | 205 |
| Соевое масло | 193 |
| Брокколи свежая/замороженная, сваренная | 192 |
| Зеленый лук | 190 |
| Фасоль | 140 |
| Салат Айсберг | 123 |
Оральные антикоагулянты, вмешиваясь в этот процесс, существенно увеличивают время свертывания крови. Однако пероральные антикоагулянты не разжижают кровь и не растворяют уже образовавшиеся сгустки крови, хотя и позволяют прекратить рост имеющихся тромбов.
В норме естественные антикоагулянты крови способствуют тому, что ее свертывание происходит только при нарушении целостности кровеносных сосудов. Однако при определенных клинических состояниях, называемых тромбозными нарушениями, этот же механизм может приводить к нежелательному образованию опасных для жизни кровяных сгустков — тромбов. В таких ситуациях действие антикоагулянтов позволяет предотвратить избыточное тромбообразование.
Если у вас обнаружили тромб или существует опасность образования кровяных сгустков, в качестве одного из элементов лечения врач может назначить лечение антикоагулянтами (например, варфарином), которые предотвращают образование тромбов.
Классификация антикоагулянтов непрямого действия
Все антикоагулянты непрямого действия подразделяются на три основные группы:
Самым распространенным непрямым антикоагулянтом является варфарин, что связано с предсказуемостью его действия и стабильными показателями антикоагуляции.
Показания к назначению пероральных антикоагулянтов
Можно выделить следующие основные причины применения оральных антикоагулянтов:
Аспирин Кардио или варфарин?
Исходя из определенных критериев (возраста и дополнительных факторов риска), лечащий врач может назначить пациентам с мерцательной аритмией, один из двух вариантов антитромботических средств: антиагрегантные препараты, например, аспирин (препятствует склеиванию тромбоцитов) или антикоагулянтные препараты, например, варфарин (блокирует факторы свертывания крови):
Фармакологическое действие аспирина как антикоагулянта заключается в угнетении слипания тромбоцитов — основного компонента тромба, таким образом, ацетилсалициловая кислота, предупреждает развитие тромбоза кровеносных сосудов.
Показанием к применению аспирина для разжижения крови является наличие преходящего нарушения мозгового кровообращения в прошлом – т.е. такого нарушения, при котором неврологическая симптоматика проявлялась не более 24 часов.
Кроме того, в инструкции по применению Аспирин Кардио для разжижения крови отдельно указан значительный перечень противопоказаний. Так же в любой инструкции к аспирину упоминается о выраженных нежелательных эффектах, развивающихся при длительном применении аспирина для разжижения крови даже в низких дозировках. При длительном приёме ацетилсалициловой кислоты, входящей в состав Аспирин Кардио, возможно развитие эрозий и язв желудочно-кишечного тракта, тромбоцитопения (снижении числа тромбоцитов), повышение уровня печёночных ферментов.
У таблеток аспирина нет явных преимуществ и в отношении стоимости. Цена «аспирина для сердца» вполне сравнима со стоимостью лечения варфарином. Даже американский аспирин для разжижения крови – далеко не панацея.
В сравнении со случаями, когда никакое лечение не проводится, варфарин снижает опасность инсульта на 64 %, что почти в три раза больше, чем при приеме аспирина для разжижения крови (для получения дополнительной информации обратитесь к врачу, который сможет рекомендовать наиболее подходящий вам препарат).
Рисунок 1. Варфарин и риск инсульта
В некоторых случаях препараты непрямых антикоагулянтов нужно принимать несколько месяцев, иногда на протяжении всей жизни. Продолжительность курса определяет врач.
Прямые и непрямые антикоагулянты снижают свертываемость крови, следовательно, повышают риск кровотечения, поэтому соблюдение режима дозирования имеет жизненно важное значение. Ни в коем случае нельзя увеличивать дозировку или сокращать интервал приема антикоагулянтов.
Первостепенное значение также имеет контроль эффективности этих препаратов: анализ крови, который называется МНО (международное нормализованное отношение), помогает подобрать наиболее оптимальную дозировку оральных антикоагулянтов.
Как работает свертывание крови?
Формирование тромба в кровотоке. Кровеносный сосуд заполнен клетками крови значительно плотнее, чем показано на этом рисунке, так что ситуация там напоминает давку при входе на эскалатор в метро. Маленькие и относительно немногочисленные белые клетки — тромбоциты: справа можно видеть, как они активируются, меняют форму и прикрепляются к стенке сосуда, формируя агрегат — тромб.
Автор
Редакторы
Свертывание крови — крайне сложный и во многом еще загадочный биохимический процесс, который запускается при повреждении кровеносной системы и ведет к превращению плазмы крови в студенистый сгусток, затыкающий рану и останавливающий кровотечение. Нарушения этой системы крайне опасны и могут привести к кровотечению, тромбозу или другим патологиям, которые совместно отвечают за львиную долю смертности и инвалидности в современном мире. Здесь мы рассмотрим устройство этой системы и расскажем о самых современных достижениях в ее изучении.
Каждый, кто хоть раз в жизни получал царапину или рану, приобретал тем самым замечательную возможность наблюдать превращение крови из жидкости в вязкую нетекучую массу, приводящее к остановке кровотечения. Этот процесс называется свертыванием крови и управляется сложной системой биохимических реакций.
Иметь какую-нибудь систему остановки кровотечения — абсолютно необходимо для любого многоклеточного организма, имеющего жидкую внутреннюю среду. Свертывание крови является жизненно необходимым и для нас: мутации в генах основных белков свертывания, как правило, летальны. Увы, среди множества систем нашего организма, нарушения в работе которых представляют опасность для здоровья, свертывание крови также занимает абсолютное первое место как главная непосредственная причина смерти: люди болеют разными болезнями, но умирают почти всегда от нарушений свертывания крови. Рак, сепсис, травма, атеросклероз, инфаркт, инсульт — для широчайшего круга заболеваний непосредственной причиной смерти является неспособность системы свертывания поддерживать баланс между жидким и твердым состояниями крови в организме.
Если причина известна, почему же с ней нельзя бороться? Разумеется, бороться можно и нужно: ученые постоянно создают новые методы диагностики и терапии нарушений свертывания. Но проблема в том, что система свертывания очень сложна. А наука о регуляции сложных систем учит, что управлять такими системами нужно особым образом. Их реакция на внешнее воздействие нелинейна и непредсказуема, и для того, чтобы добиться нужного результата, нужно знать, куда приложить усилие. Простейшая аналогия: чтобы запустить в воздух бумажный самолетик, его достаточно бросить в нужную сторону; в то же время для взлета авиалайнера потребуется нажать в кабине пилота на правильные кнопки в нужное время и в нужной последовательности. А если попытаться авиалайнер запустить броском, как бумажный самолетик, то это закончится плохо. Так и с системой свертывания: чтобы успешно лечить, нужно знать «управляющие точки».
Вплоть до самого последнего времени свертывание крови успешно сопротивлялось попыткам исследователей понять его работу, и лишь в последние годы тут произошел качественный скачок. В данной статье мы расскажем об этой замечательной системе: как она устроена, почему ее так сложно изучать, и — самое главное — поведаем о последних открытиях в понимании того, как она работает.
Как устроено свертывание крови
Остановка кровотечения основана на той же идее, что используют домохозяйки для приготовления холодца — превращении жидкости в гель (коллоидную систему, где формируется сеть молекул, способная удержать в своих ячейках тысячекратно превосходящую ее по весу жидкость за счет водородных связей с молекулами воды). Кстати, та же идея используется в одноразовых детских подгузниках, в которые помещается разбухающий при смачивании материал. С физической точки зрения, там нужно решать ту же самую задачу, что и в свертывании — борьбу с протечками при минимальном приложении усилий.
Свертывание крови является центральным звеном гемостаза (остановки кровотечения). Вторым звеном гемостаза являются особые клетки — тромбоциты, — способные прикрепляться друг к другу и к месту повреждения, чтобы создать останавливающую кровь пробку.
Общее представление о биохимии свертывания можно получить из рисунка 1, внизу которого показана реакция превращения растворимого белка фибриногена в фибрин, который затем полимеризуется в сетку. Эта реакция представляет собой единственную часть каскада, имеющую непосредственный физический смысл и решающую четкую физическую задачу. Роль остальных реакций — исключительно регуляторная: обеспечить превращение фибриногена в фибрин только в нужном месте и в нужное время.
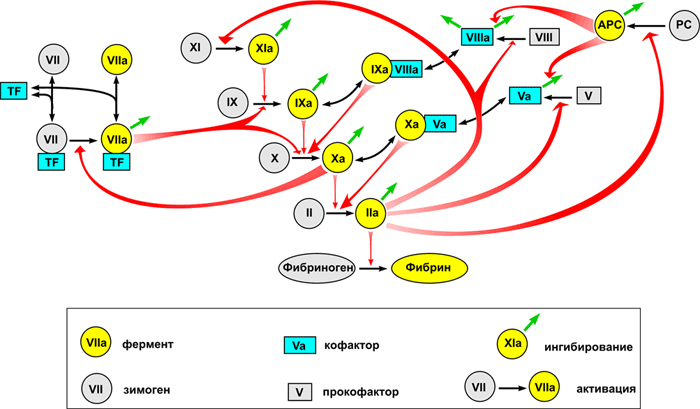
Рисунок 1. Основные реакции свертывания крови. Система свертывания представляет собой каскад — последовательность реакций, где продукт каждой реакции выступает катализатором следующей. Главный «вход» в этот каскад находится в его средней части, на уровне факторов IX и X: белок тканевый фактор (обозначен на схеме как TF) связывает фактор VIIa, и получившийся ферментативный комплекс активирует факторы IX и X. Результатом работы каскада является белок фибрин, способный полимеризоваться и образовывать сгусток (гель). Подавляющее большинство реакций активации — это реакции протеолиза, т.е. частичного расщепления белка, увеличивающего его активность. Почти каждый фактор свертывания обязательно тем или иным образом ингибируется: обратная связь необходима для стабильной работы системы.
Обозначения: Реакции превращения факторов свертывания в активные формы показаны односторонними тонкими черными стрелками. При этом фигурные красные стрелки показывают, под действием каких именно ферментов происходит активация. Реакции потери активности в результате ингибирования показаны тонкими зелеными стрелками (для простоты стрелки изображены как просто «уход», т.е. не показано, с какими именно ингибиторами происходит связывание). Обратимые реакции формирования комплексов показаны двусторонними тонкими черными стрелками. Белки свертывания обозначены либо названиями, либо римскими цифрами, либо аббревиатурами (TF — тканевый фактор, PC — протеин С, APC — активированный протеин С). Чтобы избежать перегруженности, на схеме не показаны: связывание тромбина с тромбомодулином, активация и секреция тромбоцитов, контактная активация свертывания.
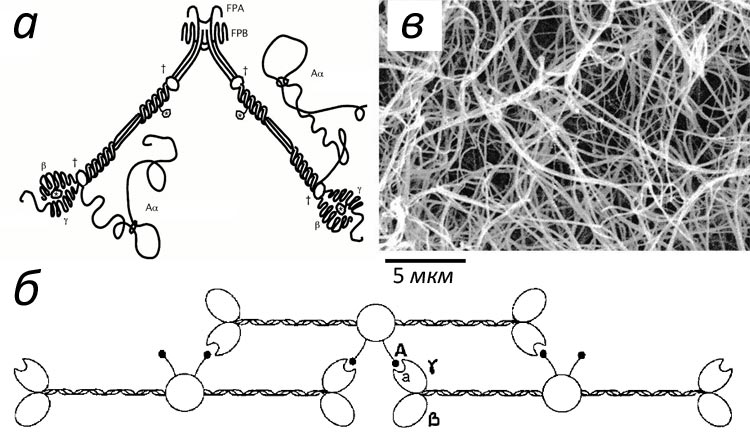
Фибриноген напоминает стержень длиной 50 нм и толщиной 5 нм (рис. 2а). Активация позволяет его молекулам склеиваться в фибриновую нить (рис 2б), а затем в волокно, способное ветвиться и образовывать трехмерную сеть (рис. 2в).
Рисунок 2. Фибриновый гель. а — Схематическое устройство молекулы фибриногена. Основа ее составлена из трех пар зеркально расположенных полипептидных цепей α, β, γ. В центре молекулы можно видеть области связывания, которые становятся доступными при отрезании тромбином фибринопептидов А и Б (FPA и FPB на рисунке). б — Механизм сборки фибринового волокна: молекулы крепятся друг к другу «внахлест» по принципу головка-к-серединке, образуя двухцепочечное волокно. в — Электронная микрофотография геля: фибриновые волокна могут склеиваться и расщепляться, образуя сложную трехмерную структуру.
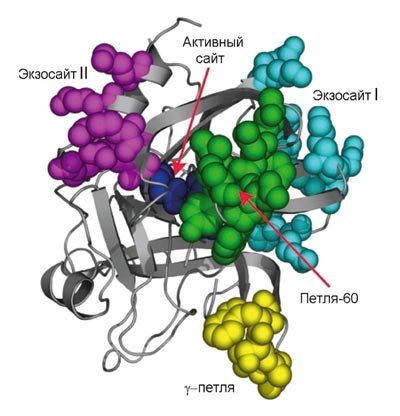
Рисунок 3. Трехмерная структура молекулы тромбина. На схеме показаны активный сайт и части молекулы, ответственные за связывание тромбина с субстратами и кофакторами. (Активный сайт — часть молекулы, непосредственно распознающее место расщепления и осуществляющее ферментативный катализ.) Выступающие части молекулы (экзосайты) позволяют осуществлять «переключение» молекулы тромбина, делая его мультифункциональным белком, способным работать в разных режимах. Например, связывание тромбомодулина с экзосайтом I физически перекрывает доступ к тромбину прокоагулянтным субстратам (фибриноген, фактор V) и аллостерически стимулирует активность по отношению к протеину C.
Активатор фибриногена тромбин (рис. 3) принадлежит к семейству сериновых протеиназ — ферментов, способных осуществлять расщепление пептидных связей в белках. Он является родственником пищеварительных ферментов трипсина и химотрипсина. Протеиназы синтезируются в неактивной форме, называемой зимогеном. Чтобы их активировать, необходимо расщепить пептидную связь, удерживающую часть белка, которая закрывает активный сайт. Так, тромбин синтезируется в виде протромбина, который может быть активирован. Как видно из рис. 1 (где протромбин обозначен как фактор II), это катализируется фактором Xa.
Вообще, белки свертывания называют факторами и нумеруют римскими цифрами в порядке официального открытия. Индекс «а» означает активную форму, а его отсутствие — неактивный предшественник. Для давно открытых белков, таких как фибрин и тромбин, используют и собственные имена. Некоторые номера (III, IV, VI) по историческим причинам не используются.
Активатором свертывания служит белок, называемый тканевым фактором, присутствующий в мембранах клеток всех тканей, за исключением эндотелия и крови. Таким образом, кровь остается жидкой только благодаря тому, что в норме она защищена тонкой защитной оболочкой эндотелия. При любом нарушении целостности сосуда тканевой фактор связывает из плазмы фактор VIIa, а их комплекс — называемый внешней теназой (tenase, или Xase, от слова ten — десять, т.е. номер активируемого фактора) — активирует фактор X.
Тромбин также активирует факторы V, VIII, XI, что ведет к ускорению его собственного производства: фактор XIa активирует фактор IX, а факторы VIIIa и Va связывают факторы IXa и Xa, соответственно, увеличивая их активность на порядки (комплекс факторов IXa и VIIIa называется внутренней теназой). Дефицит этих белков ведет к тяжелым нарушениям: так, отсутствие факторов VIII, IX или XI вызывает тяжелейшую болезнь гемофилию (знаменитую «царскую болезнь», которой болел царевич Алексей Романов); а дефицит факторов X, VII, V или протромбина несовместим с жизнью.
Такое устройство системы называется положительной обратной связью: тромбин активирует белки, которые ускоряют его собственное производство. И здесь возникает интересный вопрос, а зачем они нужны? Почему нельзя сразу сделать реакцию быстрой, почему природа делает ее исходно медленной, а потом придумывает способ ее дополнительного ускорения? Зачем в системе свертывания дублирование? Например, фактор X может активироваться как комплексом VIIa—TF (внешняя теназа), так и комплексом IXa—VIIIa (внутренняя теназа); это выглядит совершенно бессмысленным.
В крови также присутствуют ингибиторы протеиназ свертывания. Основными являются антитромбин III и ингибитор пути тканевого фактора. Кроме этого, тромбин способен активировать сериновую протеиназу протеин С, которая расщепляет факторы свертывания Va и VIIIa, заставляя их полностью терять свою активность.
Протеин С — предшественник сериновой протеиназы, очень похожей на факторы IX, X, VII и протромбин. Он активируется тромбином, как и фактор XI. Однако при активации получившаяся сериновая протеиназа использует свою ферментативную активность не для того, чтобы активировать другие белки, а для того, чтобы их инактивировать. Активированный протеин С производит несколько протеолитических расщеплений в факторах свертывания Va и VIIIa, заставляя их полностью терять свою кофакторную активность. Таким образом, тромбин — продукт каскада свертывания — ингибирует свое собственное производство: это называется отрицательной обратной связью. И опять у нас регуляторный вопрос: зачем тромбин одновременно ускоряет и замедляет собственную активацию?
Эволюционные истоки свертывания
Формирование защитных систем крови началось у многоклеточных свыше миллиарда лет назад — собственно, как раз в связи с появлением крови. Сама система свертывания является результатом преодоления другой исторической вехи — возникновения позвоночных около пятисот миллионов лет назад. Скорее всего, эта система возникла из иммунитета. Появление очередной системы иммунных реакций, которая боролась с бактериями путем обволакивания их фибриновым гелем, привело к случайному побочному результату: кровотечение стало прекращаться быстрее. Это позволило увеличивать давление и силу потоков в кровеносной системе, а улучшение сосудистой системы, то есть улучшение транспорта всех веществ, открыло новые горизонты развития. Кто знает, не было ли появление свертывания тем преимуществом, которое позволило позвоночным занять свое нынешнее место в биосфере Земли?
У ряда членистогих (таких, как рак-мечехвост) свертывание также существует, но оно возникло независимо и осталось на иммунологических ролях. Насекомые, как и прочие беспозвоночные, обычно обходятся более слабой разновидностью системы остановки кровотечения, основанной на агрегации тромбоцитов (точнее, амебоцитов — дальних родственников тромбоцитов). Этот механизм вполне функционален, но накладывает принципиальные ограничения на эффективность сосудистой системы, — так же, как трахейная форма дыхания ограничивает максимально возможный размер насекомого.
К сожалению, существа с промежуточными формами системы свертывания почти все вымерли. Единственным исключением являются бесчелюстные рыбы: геномный анализ системы свертывания у миноги показал, что она содержит гораздо меньше компонентов (то есть, устроена заметно проще) [6]. Начиная же с челюстных рыб и до млекопитающих системы свертывания очень похожи. Системы клеточного гемостаза также работают по схожим принципам, несмотря на то, что мелкие, безъядерные тромбоциты характерны только для млекопитающих. У остальных позвоночных тромбоциты — крупные клетки, имеющие ядро.
Подводя итог, система свертывания изучена очень хорошо. В ней уже пятнадцать лет не открывали новых белков или реакций, что для современной биохимии составляет вечность. Конечно, нельзя совсем исключить вероятность такого открытия, но пока что не существует ни одного явления, которое мы не могли бы объяснить при помощи имеющихся сведений. Скорее наоборот, система выглядит гораздо сложнее, чем нужно: мы напомним, что из всего этого (довольно громоздкого!) каскада собственно желированием занимается только одна реакция, а все остальные нужны для какой-то непонятной регуляции.
Именно поэтому сейчас исследователи-коагулологи, работающие в самых разных областях — от клинической гемостазиологии до математической биофизики, — активно переходят от вопроса «Как устроено свертывание?» к вопросам «Почему свертывание устроено именно так?», «Как оно работает?» и, наконец, «Как нам нужно воздействовать на свертывание, чтобы добиться желаемого эффекта?». Первое, что необходимо сделать для ответа — научиться исследовать свертывание целиком, а не только отдельные реакции.
Как исследовать свертывание?
Для изучения свертывания создаются различные модели — экспериментальные и математические. Что именно они позволяют получить?
С одной стороны, кажется, что самым лучшим приближением для изучения объекта является сам объект. В данном случае — человек или животное. Это позволяет учитывать все факторы, включая ток крови по сосудам, взаимодействия со стенками сосудов и многое другое. Однако в этом случае сложность задачи превосходит разумные границы. Модели свертывания позволяют упростить объект исследования, не упуская его существенных особенностей.
Попытаемся составить представление о том, каким требованиям должны отвечать эти модели, чтобы корректно отражать процесс свертывания in vivo.
В экспериментальной модели должны присутствовать те же биохимические реакции, что и в организме. Должны присутствовать не только белки системы свертывания, но и прочие участники процесса свертывания — клетки крови, эндотелия и субэндотелия. Система должна учитывать пространственную неоднородность свертывания in vivo: активацию от поврежденного участка эндотелия, распространение активных факторов, присутствие тока крови.
Рассмотрение моделей свертывания естественно начать с методов исследования свертывания in vivo. Основа практически всех используемых подходов такого рода заключается в нанесении подопытному животному контролируемого повреждения с тем, чтобы вызвать гемостатическую или тромботическую реакцию. Данная реакция исследуется различными методами:
Рисунок 4. Формирование тромба in vivo в модели тромбоза, индуцированного лазером. Эта картинка воспроизведена из исторической работы, где ученые впервые смогли пронаблюдать развитие тромба «вживую». Для этого в кровь мыши впрыснули концентрат флуоресцентно меченных антител к белкам свертывания и тромбоцитам, и, поместив животное под объектив конфокального микроскопа (позволяющего осуществлять трехмерное сканирование), выбрали доступную для оптического наблюдения артериолу под кожей и повредили эндотелий лазером. Антитела начали присоединяться к растущему тромбу, сделав возможным его наблюдение.
Классическая постановка эксперимента по свертыванию in vitro заключается в том, что плазма крови (или цельная кровь) смешивается в некоторой емкости с активатором, после чего производится наблюдение за процессом свертывания. По методу наблюдения экспериментальные методики можно разделить на следующие типы:
Второй подход дает несравненно больше информации. Теоретически, зная концентрации всех факторов в произвольный момент времени, можно получить полную информацию о системе. На практике исследование даже двух белков одновременно дорого и связано с большими техническими трудностями.
Наконец, свертывание в организме протекает неоднородно. Формирование сгустка запускается на поврежденной стенке, распространяется с участием активированных тромбоцитов в объеме плазмы, останавливается с помощью эндотелия сосудов. Адекватно изучить эти процессы с помощью классических методов невозможно. Вторым важным фактором является наличие потока крови в сосудах.
Осознание этих проблем привело к появлению, начиная с 1970-х годов, разнообразных проточных экспериментальных систем in vitro. Несколько больше времени потребовалось на осознание пространственных аспектов проблемы. Только в 1990-е годы стали появляться методы, учитывающие пространственную неоднородность и диффузию факторов свертывания, и только в последнее десятилетие они стали активно использоваться в научных лабораториях (рис. 5).
Рисунок 5. Пространственный рост фибринового сгустка в норме и патологии. Свертывание в тонком слое плазмы крови активировалось иммобилизованным на стенке тканевым фактором. На фотографиях активатор расположен слева. Серая расширяющаяся полоса — растущий фибриновый сгусток.
Наряду с экспериментальными подходами для исследований гемостаза и тромбоза также используются математические модели (этот метод исследований часто называется in silico [8]). Математическое моделирование в биологии позволяет устанавливать глубокие и сложные взаимосвязи между биологической теорией и опытом. Проведение эксперимента имеет определенные границы и сопряжено с рядом трудностей. Кроме того, некоторые теоретически возможные эксперименты неосуществимы или запредельно дороги вследствие ограничений экспериментальной техники. Моделирование упрощает проведение экспериментов, так как можно заранее подобрать необходимые условия для экспериментов in vitro и in vivo, при которых интересующий эффект будет наблюдаем.
Регуляция системы свертывания
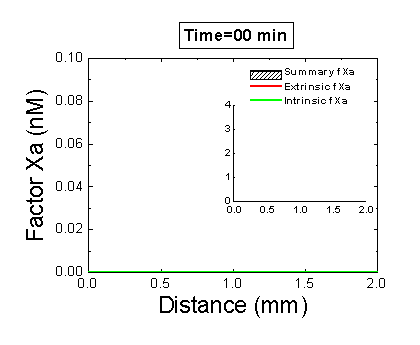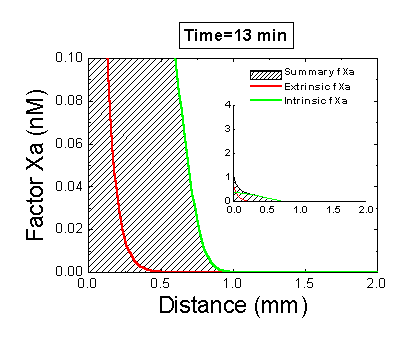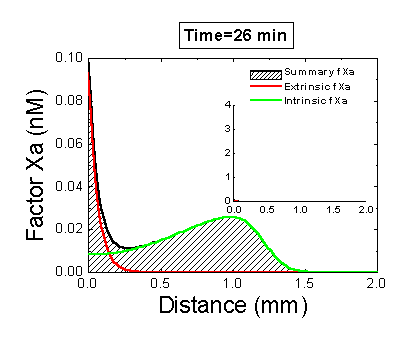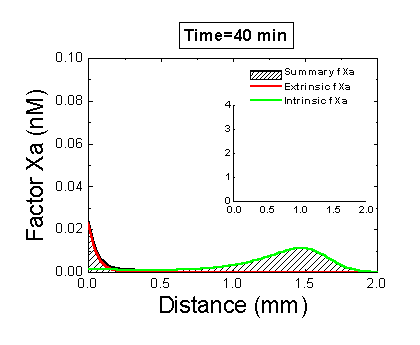
Рисунок 6. Вклад внешней и внутренней теназы в формирование фибринового сгустка в пространстве. Мы использовали математическую модель, чтобы исследовать, как далеко может простираться влияние активатора свертывания (тканевого фактора) в пространстве. Для этого мы посчитали распределение фактора Xa (который определяет распределение тромбина, который определяет распределение фибрина). На анимации показаны распределения фактора Xa, произведенного внешней теназой (комплексом VIIa–TF) или внутренней теназой (комплексом IXa–VIIIa), а также общее количество фактора Xa (заштрихованная область). (Вставка показывает то же самое на более крупной шкале концентраций.) Можно видеть, что произведенный на активаторе фактор Xa не может проникнуть далеко от активатора из-за высокой скорости ингибирования в плазме. Напротив, комплекс IXa–VIIIa работает вдали от активатора (т.к. фактор IXa медленнее ингибируется и потому имеет большее расстояние эффективной диффузии от активатора), и обеспечивает распространение фактора Xa в пространстве.
Сделаем следующий логический шаг и попробуем ответить на вопрос — а как описанная выше система работает?
Каскадное устройство системы свертывания
Запуск свертывания и роль положительных обратных связей
Как упоминалось в первой части статьи, многие реакции свертывания медленны. Так, факторы IXa и Xa сами по себе являются очень плохими ферментами и для эффективного функционирования нуждаются в кофакторах (факторах VIIIa и Va, соответственно). Эти кофакторы активируются тромбином: такое устройство, когда фермент активирует собственное производство, называется петлей положительной обратной связи.
Как было показано нами экспериментально и теоретически, положительная обратная связь активации фактора V тромбином формирует порог по активации — свойство системы не реагировать на малую активацию, но быстро срабатывать при появлении большой. Подобное умение переключаться представляется весьма ценным для свертывания: это позволяет предотвратить «ложное срабатывание» системы.
Роль внутреннего пути в пространственной динамике свертывания
Одной из интригующих загадок, преследовавших биохимиков на протяжении многих лет после открытия основных белков свертывания, была роль фактора XII в гемостазе. Его дефицит обнаруживался в простейших тестах свертывания, увеличивая время, необходимое для образования сгустка, однако, в отличие от дефицита фактора XI, не сопровождался нарушениями свертывания.
Один из наиболее правдоподобных вариантов разгадки роли внутреннего пути был предложен нами с помощью пространственно неоднородных экспериментальных систем. Было обнаружено, что положительные обратные связи имеют большое значение именно для распространения свертывания. Эффективная активация фактора X внешней теназой на активаторе не поможет сформировать сгусток вдали от активатора, так как фактор Xa быстро ингибируется в плазме и не может далеко отойти от активатора. Зато фактор IXa, который ингибируется на порядок медленнее, вполне на это способен (и ему помогает фактор VIIIa, который активируется тромбином). А там, куда сложно дойти и ему, начинает работать фактор XI, также активируемый тромбином. Таким образом, наличие петель положительных обратных связей помогает создать трехмерную структуру сгустка.
Путь протеина С как возможный механизм локализации тромбообразования
Активация протеина С тромбином сама по себе медленна, но резко ускоряется при связывании тромбина с трансмембранным белком тромбомодулином, синтезируемым клетками эндотелия. Активированный протеин С способен разрушать факторы Va и VIIIa, на порядки замедляя работу системы свертывания. Ключом к пониманию роли данной реакции стали пространственно-неоднородные экспериментальные подходы. Наши эксперименты позволили предположить, что она останавливает пространственный рост тромба, ограничивая его размер.
Подведение итогов
В последние годы сложность системы свертывания постепенно становится менее загадочной. Открытие всех существенных компонентов системы, разработка математических моделей и использование новых экспериментальных подходов позволили приоткрыть завесу тайны. Структура каскада свертывания расшифровывается, и сейчас, как мы видели выше, практически для каждой существенной части системы выявлена или предложена роль, которую она играет в регуляции всего процесса.
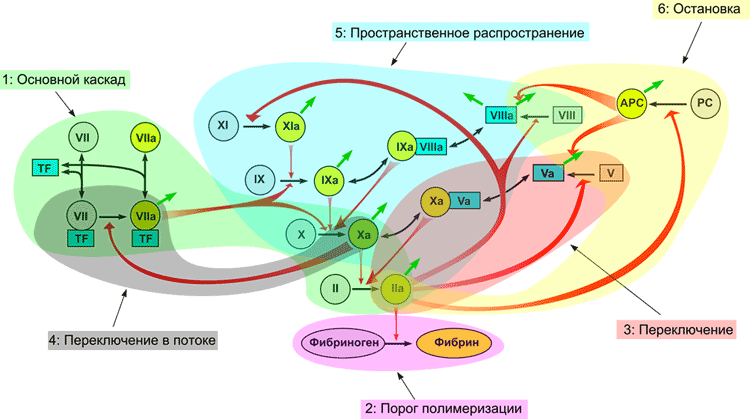
На рисунке 7 представлена наиболее современная попытка пересмотреть структуру системы свертывания. Это та же схема, что и на рис. 1, где разноцветным затенением выделены части системы, отвечающие за разные задачи, как обсуждалось выше. Не все в этой схеме является надежно установленным. Например, наше теоретическое предсказание, что активация фактора VII фактором Xa позволяет свертыванию пороговым образом отвечать на скорость потока, остается пока еще непроверенным в эксперименте.
Рисунок 7. Модульная структура системы свертывания: роль отдельных реакций свертывания в функционировании системы.
Вполне возможно, что эта картина еще не вполне полна. Тем не менее, прогресс в этой области в последние годы вселяет надежду, что в обозримом будущем оставшиеся неразгаданные участки на схеме свертывания обретут осмысленную физиологическую функцию. И тогда можно будет говорить о рождении новой концепции свертывания крови, пришедшей на смену старинной каскадной модели, которая верно служила медицине на протяжении многих десятилетий.
Статья написана при участии А.Н. Баландиной и Ф.И. Атауллаханова и была в первоначальном варианте опубликована в «Природе» [10].


 Читайте также:
Читайте также: